moment de dipol permanent
Procesul de apariție a dipol
În timpul formării legăturilor covalente ale atomilor polare de unul mai puternic atrage electroni, rezultând într-un total de schimburi pereche de electroni la miezul său. Există o legătură covalentă polară. Capacitatea unui atom de a atrage electroni criteriu este electronegativitate sa (EO). Electronegativitatea mai mare a unui atom este, cu atât mai mare probabilitatea de deplasare a perechii de electroni în direcția nucleului atomului. Diferența atomilor EO caracterizează polaritatea conexiunii.
Ca urmare a deplasării unei perechi de electroni la miezul unuia dintre atomii crește densitatea de sarcină negativă la un anumit atom, și devine încărcătura efectivă a atomului $ \ delta ^ - $. Ceilalți atomi crește densitatea sarcinii pozitive de $ \ delta ^ + $. Există un dipol - un sistem electric neutru cu două identice în mărime, dar în semn opus tarifelor situate la o anumită distanță (lungimea de dipol $ l_d $) unul față de celălalt.
moment de dipol permanent
O măsură a polarității unui moment de dipol $ \ mu $. Valoarea sa este egală cu produsul dintre taxa efectivă de $ \ delta $ pe lungimea dipolului l_d $ $:
Unitatea moment de dipol permanent - coulomb pe metru ($ Cl \ cdot m $) sau off-sistem unitate de măsură - Debye $ D $, este egal cu $ 3,34 \ cdot 10-30 Cl \ cdot $ m.
Să presupunem că într-o moleculă de HF $ HF $ - legătură ionică. Adică, atomii de hidrogen și taxele de fluor concentrat $ + 1 $ și $ $ 1, respectiv. Acuzațiile de ioni sunt multipli de taxa de electroni egală cu $ 1,60 \ cdot 10 ^ $ Cl. Distanța dintre tarifele este de $ 9,17 \ cdot 10 ^ m $ dipol permanent moment de la aceste date, este .:
$ \ Mu = q \ cdot r = 1,60 \ cdot 10 ^ KI \ cdot 9,17 \ cdot 10 ^ m = 1,47 \ cdot 10 Kl \ cdot $ m.
Momentul de dipol Debye este:
Valoarea $ \ mu = 4,40 D $ caracterizează momentul de dipol al moleculei $ HF $ cu condiția ca legătura chimică în ea pe deplin ionic. De fapt, $ \ mu = 1,83 D $. Comparând aceste valori, se poate calcula „ionicity obligațiuni parts“ (caracter ionic parțial) în molecula $ HF $.
Cu o creștere a diferenței de electronegativitate dipol permanente creșteri de moment.
Momentul dipol este o cantitate vector. condiționat primesc direcția dipol de la polul negativ la pozitiv.
La molecule $ NH_3 $ amoniac și azot fluorura $ NF_3 $ identice trigonala - formă piramidală (figura 1.). legături polarității $ N-H $ și $ N-F $ este, de asemenea, aproximativ la fel. Cu toate acestea, momentul de dipol de amoniac este egal cu $ de 0,49 \ cdot 10 ^ Cl \ cdot m $, și fluorură de azot - $ de 0,07 \ cdot 10 ^ Cl \ cdot $ m. Această diferență se explică prin faptul că molecula de amoniac direcția momentului dipol conectarea $ N-H $ și perechea de electroni nonbonding coincide cu adăugarea vector conduce la momentul dipol electric mai mare. Sub o fluorură de azot molecula dipol momente obligațiuni $ N-F pereche de electroni $ și orientate în direcții opuse. Dacă adăugați-le în sus, atunci există o compensație parțială.
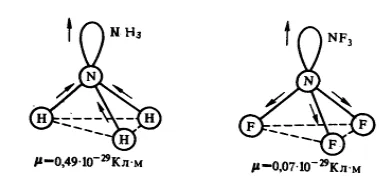
Figura 1. Direcția momentelor dipol și perechile de electroni în moleculele $ NH_3 $ amoniac si fluorura de azot $ NF_3 $
Pentru moleculele poliatomice, este necesar să se facă distincția între momentul de dipol de obligațiuni individuale și molecula ca întreg. În cazul în care molecula conține mai multe link-uri, momentele lor electrice (vectori) sunt formate prin regula paralelogramului. Rezultant momentul de dipol va fi diferit de momentele electrice dipol de obligațiuni individuale. În cazul în care molecula este extrem de simetrică, momentul de dipol poate fi zero, în timp ce comunicarea individuală au polaritate ridicată.
Rezolvarea controlului în toate subiectele. 10 ani de experiență! Preț de la 100 de ruble. Perioada de la 1 zi!
Molecule este forma liniară de dioxid de carbon este nepolari ($ \ mu = 0 $), în timp ce fiecare link $ C = O $ are un moment semnificativ dipol ($ \ mu = 8.9 \ cdot 10 ^ Cl \ cdot $ m). Acest lucru se datorează faptului că relațiile egale cu magnitudinea momentelor de dipol permanente sunt îndreptate unul către celălalt.
Moleculele mai polare si mai mari perechi de electroni de ansamblu sunt decalate unul dintre atomii, cu atât mai mult valoarea momentului de dipol permanent.
Metode de determinare a momentului de dipol permanent
În general, metodele de determinare a momentelor electrice dipolilor bazate pe găsirea efectului de orientare a moleculelor polare în câmpul electric aplicat.
Metode de spectroscopie cu microunde. Pe baza efectelor de forfecare și divizarea liniilor spectrale în câmpul electric. Acest lucru permite să se determine cu mai multă precizie valoarea magnitudinea și direcția vectorului momentului de dipol permanent. Aceste metode includ: metoda Stark, metoda cu microunde rezonant, fascicul molecular, și altele.
Metode bazate pe măsurarea constanta dielectrică a $ \ $ varepsilon substanta.
Substanțe permitivitate măsurate la diferite temperaturi. Dacă substanța este plasată într-un câmp electric generat de un condensator, capacitatea va crește. timp, adică,
unde $ c_0 $ și $ c $ - condensator în vid și substanța în mediu.
Energia câmpului electric în condensator este egal cu:
în cazul în care $ U $ - energie câmp electric în condensator;
$ C $ - material de capacitate în mediu;
$ V $ - tensiune pe plăcile condensatorului.
Condensatorul substanță medie are un conținut de energie mai mare decât în vid. Acest lucru se datorează faptului că câmpul electric determină orientarea dipol și deformarea moleculelor substanței.
moment de dipol permanent este găsit de ecuația Lanzheneva - Debye, care leagă dependența de temperatură a dielectric momentul constantă și dipol:
unde $ M $ - masa moleculară relativă a substanței;
$ N_a $ - numărul lui Avogadro;
$ K $ - constanta Boltzmann, care este egal cu $ \ frac $;
$ $ R - constanta universală a gazelor;
$ \ Alpha $ - deformare polarizabilitatea.
Prin măsurarea $ \ varepsilon $ la două temperaturi folosind ecuația Langevin - Debye este posibil să se determine polarizabilitatea deformare și un moment de dipol permanent.
Cunoscând cantitatea de momentul dipolar poate indica natura legăturii chimice (covalentă polară sau nepolară, ionică) și judeca structura geometrică a moleculei.