echilibru de fază într-un singur component sistem
Sisteme cu un component de fază echilibrelor
Prin evaporare, topire, sublimare (sublimare) exemple de schimbări în starea materiei, nu este însoțită de o modificare a compoziției chimice.
Substanțe de fază este o stare de uniformă materiei în compoziția chimică și proprietățile fizice. Sunt în fază solidă, lichidă, gazoasă. faze solide pentru una și aceeași substanță poate diferi, de exemplu, fosfor modificarea alotropic (fosfor alb și negru).
tranziție de fază această conversie spontană a unei faze la alta, care are loc la o presiune definită pentru o temperatură dată.
Temperatura de tranziție de fază


Diagrama de fază - o imagine grafică în coordonate „presiune-temperatură“, care arată grafic temperatura și presiunea în care diferite fază stabilă termodinamic a substanței.
limitele de fază sunt linii care separă aceste zone. Orice punct de pe aceste linii (limite de fază) aparține simultan atât regiunea de fază, adică conține un echilibru în două faze. Acest echilibru se observă în presiunea și temperatura corespunzătoare.
Luați în considerare detaliile care arată limitele de fază.
Faza de delimitare care separă regiunea solidă și regiunea lichidă a materiei, prezintă dependența temperaturii de topire la presiunea.
Temperatura Temperatura este numită T, care la o presiune dată corespunde unei stări de echilibru între fazele lichide și solide de materie de topire. Substanța se topește la aceeași temperatură, care se solidifică și, prin urmare, temperatura de topire este temperatura de cristalizare (congelare). Dacă presiunea este de 1 atm și apoi obține un punct de topire normal (congelare).
Pe limita de fază între o regiune de existență stabilă a lichidului și o suprafață de existență stabilă a lichidului de gaz și de gaz sunt în echilibru. Dar faza gazoasă pură a unei substanțe care este în echilibru cu această substanță în stare lichidă (sau în stare solidă) se numește substanță abur saturat. Presiunea vaporilor în echilibru cu lichidul, numita substanță de presiune a vaporilor. Prin urmare, faza de delimitare diagrama de fază zhidkostpar arată modul în care presiunea de vapori a substanței lichide în funcție de temperatură.
De asemenea, în faza solidă perechi de linii de echilibru arată efectul temperaturii asupra valorii presiunii vaporilor saturați prin sublimare.
La încălzirea lichidului într-un vas deschis, merge evaporarea ei de suprafață. Când temperatura este atinsă la care presiunea de vapori este egală cu presiunea externă, procesul vaporizarea va acoperi întregul volum de lichid și vapori începe să se răspândească în mediul înconjurător. Procesul vaporizarea fără volum de lichid numit evaporare.
Temperatura la care presiunea vaporilor lichidului saturat devine egală cu presiunea externă, punctul de fierbere este numit la o presiune dată. Dacă presiunea externă este de 1 atm, punctul de fierbere este numit un punct de fierbere normal.
Atunci când un set de variabile termodinamice în trei faze de echilibru poate fi simultan: lichid + solid + vapori sau lichid + solid (modificarea 1) + solid (Modificare 2). Pe diagrama de fază a acestui fenomen corespunde punctului triplu. care se intersectează limita de trei faze. Așa cum se va arăta mai târziu, poziția punctului triplu al impactului nu poate fi realizată atunci când este, presiune unică bine definită și caracteristică a temperaturii pentru substanța.
În cazul în care lichidul este încălzit într-un vas închis, acesta va fi și alte evenimente. Deoarece temperatura de presiune a vaporilor va crește, și, prin urmare, va crește și densitatea de masă. În același timp, densitatea de masă a lichidului va scădea datorită expansiunii sale. La un moment dat densitatea masei de vapori de lichid și devin identice, iar granița dintre cele două faze dispare. Temperatura la care se produce acest fenomen se numește temperatura critică a substanței și presiunea vaporilor corespunzătoare temperaturii critice, presiunea critică . La temperaturi peste punctul critic nu există o fază lichidă separată și faza de vapori (sau faza de delimitare există zhidkostpar). Într-un vas închis la o temperatură peste faza critică există o substanță unică numită un fluid supercritic. Acesta ocupă întregul volum al containerului închis.
Acceptate fază gazoasă peste temperatura critică într-un vas deschis, numit gaz și abur situată sub temperatura critică. Acesta poate fi, de asemenea, remarcat faptul că peste temperatura critică, gazul la presiunile nu poate fi transferată în faza lichidă.
Condițiile de echilibru de fază.


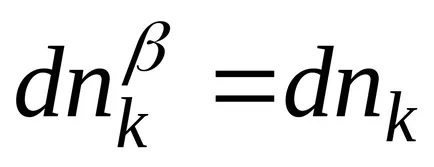

Coordonate PKR punct critic pentru apă. = 218 atm și tcr. = 374 ° C
OA și OC curbe reprezintă dependența presiunii de vapori saturați deasupra apei lichide și, prin urmare, peste temperatura gheții, și linia OB dependența punct de apă (sau topirea gheții) a presiunii de congelare. Apa panta caracteristică a liniei de OB din stânga, ceea ce corespunde unei scăderi a temperaturii de topire a gheții cu o presiune tot mai mare. Curba este o continuare a curbei OD OS și determină presiunea de vapori a apei lichide racim. OD pe vaporii de parcelă și apă sunt într-o stare metastabile (în starea corespunzătoare echilibrului instabil). Metastabile Agenții de stat au o marjă mare de energie Gibbs, decât într-o stare stabilă și potențialul lor chimică este mai mare decât potențialul chimic într-o stare stabilă. Prin urmare, nu va avea loc o tranziție spontană a unei substanțe dintr-o stare metastabilă la grajd. Pe oricare dintre liniile de delimitare ale variației sistemului este egal cu unu. Acest lucru înseamnă că unul dintre parametrii (fie de presiune sau temperatură) poate fi variată în mod arbitrar, o altă opțiune nu va rămâne constantă, dar va varia în conformitate cu primul. Apoi, numărul de faze în echilibru, va rămâne același, și anume, egal cu doi pe liniile de echilibru de fază.
Coordonatele punctului triplu în pt.t. de joasă presiune = 4,6 mm Hg și tt.t. = 0,0098 până la C (punctul D din figura 3). La acest sistem bezvariantna punct, numărul este de trei faze în echilibru. Cea mai mică schimbare oricare dintre parametrii duce la dispariția uneia sau a două faze. De exemplu, creșterea temperaturii la advlenii constantă sau de reducere a presiunii la sistem temperautre constant în stare de vapori. Creșterea presiunii la o temperatură constantă a sistemului în stare lichidă a apei și scăderea temperaturii la presiune constantă în condiții de gheață.
Fig. se observă că există modificări de gheață, gheață 9. Trebuie remarcat faptul că diferite modificări ale deschiderii de gheață existente la presiuni mai mari, nu numai de interes pentru oameni de știință, dar, de asemenea, afectate de muzicieni și scriitori. Cunoscut album semantic Halucinații, numit Ice 9. O carte de scriitorul american Kurt Vonnegut „Cradle Cat,“ unul dintre capetele de așa-numitul Lod9. În această lucrare, naratorul pe nume John lucrează la o carte despre bomba atomică de la Hiroshima. Se pare că unul dintre creatorii bombei, Felix Honniker, a inventat o substanță care se poate transforma în gheață toată apa de pe Pământ Lod9. Acest fantastic Lod9 are o temperatură de topire de aproximativ 114,4 F, sau bazat pe scara Celsius

Dacă te duci din exemplul literar din nou la diagrama de fază de gheață, puteți vedea că aici, de asemenea, există mai multe limite de fază și punctele în care cele trei faze sunt în echilibru. Unele puncte triple caracterizează echilibrul a două modificări de gheață și apă în stare lichidă, unele trei modificări de gheață.
Interesant, la o presiune de aproximativ 40.000 VII gheață atm este în echilibru cu apă în stare lichidă, la o temperatură de aproximativ 200 ° C, de ex E fierbinte.
Limitele de fază în diagramele de stare
ecuația KlauziusaKlapeyrona
Să considerăm ecuația de echilibru general încheiat cele două faze. și

,
unde






Acum am echivala diferențele de potențial chimic:
Notăm diferența de fază dintre entropiile molare
și numesc această cantitate schimbare de entropie molară la trecerea de la faza


In mod similar, pentru volumul molar
Ecuațiile Substituind (22) și (23) în (21) și pentru rezultate suplimentare de transformare într-o formă de ecuații KlauziusaKlapeyrona
Pe de altă parte, este cunoscut faptul că, la temperatură și presiune (adică constantă, este o condiție de echilibru a celor două faze, și anume acesta corespunde oricărui punct de pe linia de echilibru
Folosind relația (25) poate primi o altă formă de ecuație KlauziusaKlapeyrona
ecuații KlauziusaKlapeyrona dau posibilitatea de a găsit experiența pentru a calcula dependențe

Faza limita veschestvozhidkost solide
tranziție de fază a fazei lichide de delimitare solid este fie procesul de topire (faza apoi o fază lichidă faza finită și tverdoe această stare fază inițială) sau proces de cristalizare (timpul fază o finită faza stare solidă și fază este inițial lichid faza). Figura 3, diagrama de faza a apei, această limită de fază este desemnată OB. tranziții de fază și circuitul are forma:
.
Următoarele relații
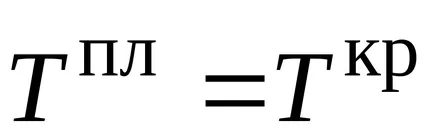




și ecuația KlauziusaKlapeyrona, de exemplu, pentru procesul de topire poate fi scris după cum urmează
unde

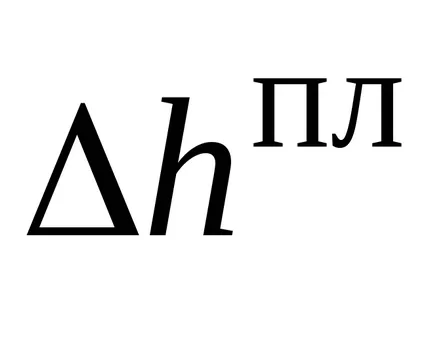

Analizeaza Ecuația (27). Cantitatea pe stânga - este o chestiune de fapt - panta liniei de delimitare în davlenietemperatura coordonate. Molar Schimbarea entalpie de topire aproape întotdeauna pozitiv (cu excepția de gheață și alte câteva substanțe). Schimbarea volumului molar în timpul topirii este cel mai adesea pozitiv, dar este mic. Prin urmare, putem spune că panta liniei de echilibru între solid și lichid este întotdeauna de mare, de obicei, pozitivă și constantă într-un interval destul de mare de presiuni. Topirea curba este aproape o linie dreaptă.
Ecuația (27) pot fi integrate, presupunând că în acest interval de temperatură de fuziune entalpie molară audio, schimbare audio volum molar la topire nu depinde de temperatură și presiune. Apoi, în mod explicit limita ecuația liniei în coordonatele temperaturadavlenie va arata:
unde

Faza limită lichid - vapori
Tranziția de fază de la lichid - gaz poate fi fie evaporare sau condens. Figura 3, această limită de fază indicată de sistemul de operare. un proces care are loc în această fază de delimitare poate fi reprezentat schema:
.
Ecuația KlauziusaKlapeyrona pentru evaporare poate fi scrisă ca:
unde T fază temperatură de tranziție, adică punctul de fierbere;


Deoarece linia va fi localizat, care caracterizează evaporarea în raport cu linia anterioară de fuziune?

Dacă valoarea volumului molar al efectului creșterii presiunii lichidului nu este foarte important, atunci valoarea cantitatea molară de abur conform ecuației MendeleevaKlapeyrona, scade cu o presiune tot mai mare. În general, scade, iar modificarea volumului molar prin evaporare și astfel crește valoarea
