Cheat - elemente ale d-bloc periodic
1. Proprietățile chimice și blocul elementovd rol biologic
K d -bloc includ 32 de elemente ale sistemului periodic. Acestea sunt situate în subgrupuri laterale 4-7 ale sistemului periodic, în perioade mari între elementele și p s-.
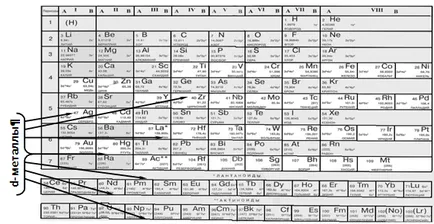
O trăsătură caracteristică a elementelor d-bloc este că atomii lor nu ultimul umplut orbitalii stratului exterior (ca în p-S și componente) și predvneshnego [(n - 1) d] strat. În acest sens, la d-valență elemente sunt energetic aproape nouă orbitali - una ns-orbitale trei Orbitali externe np și cinci (n - 1) nivelul de energie d-orbital predvneshnego:
Structura cochilii electronice externe ale atomilor descriși de către blocul de formula d (n-1) da NSB. unde a = 1
2. Elemente harakteristikad generale
În perioadele (stânga) cu creșterea sarcina nucleară a razei atom crește încet, în mod disproporționat la numărul de electroni care ocupă învelișul atomului.
Motive - compresie lanthanoid și ns de penetrare a electronilor sub stratul d electronic (în conformitate cu principiul energiei minime). SURVINE ecranare miez de încărcare electroni de valență exterioară pentru elementele patra perioadă a electronilor exteriori penetrează ecran subnivelul 3d-electron, în timp ce elementele din perioada a 6 - a 4f ecran și electronii 5d (screening-ul dublu).
In perioada (de la stânga la dreapta) au observat o scădere a energiei de ionizare, energia de afinitate de electroni. Deoarece schimbarea energiei de ionizare și afinitatea de electroni sunt nesemnificative, proprietățile chimice ale elementelor și compușii acestora variază foarte puțin.
În grupuri (în jos) cu creșterea încărcare nucleu atomic creste energia de ionizare, elemente relative electronegativitate (OEO) cresc metalice și acide proprietăți, reduse metalice proprietăți membre.
3. acido-bazic proprietăți și redox și variația acestora
Elementele D-bloc sunt în III, IV, V, VI, grupurile VIIB au strat incomplet d-electron (predvneshny en. Level). Aceste coji de electroni sunt instabile. Aceasta explică valență variabilă, precum și posibilitatea de a arăta diferite grade de oxidare a d-elemente. Oxidarea elemente d-bloc din compușii sunt întotdeauna numai pozitive.
Compuși cu un grad mai mare de oxidare prezintă proprietăți acide și oxidante (în soluțiile prezentate anioni de oxigen). Compușii cu grade mai mici de oxidare - reducere și proprietăți de bază (reprezentate de cationi în soluție). Compuși cu oxidare intermediar - prezintă proprietăți amfoteri.
În perioada cu creșterea încărcare nucleu atomic scade stabilitatea compușilor cu cel mai înalt grad de oxidare crește proprietățile lor de oxidare.
În grupuri crește stabilitatea compușilor cu cel mai înalt grad de oxidare crește și scade proprietățile de reducere a oxidative ale elementelor.
4. Elemente de Redox svoystvad în corpul uman
Datorită varietății de grade de-elemente 3d chimie oxidare tipică de reacție redox.
La rândul său, capacitatea de-elemente 3d pentru a varia gradul de oxidare, care acționează ca agenți de oxidare sau de reducere, este baza unui număr mare de reacții biologice importante.
În cursul evoluției, natura selectate elementele gradul de oxidare, că acestea nu erau oxidanți puternici sau agenți de reducere puternici.
Fiind în d-elemente ale corpului uman, în cea mai mare stare de oxidare posibilă numai dacă aceste elemente sunt proprietăți redox slabe.
De exemplu, Mo + 6 în compuși complecși din corp în corp are starea de oxidare +5 și +6.
Cationii Fe + 3 și Cu + 2 în fluide biologice nu prezintă proprietăți de reducere.
Existența compușilor în oxidare inferior justificată pentru organism. Ionii Mn + 2, Co + 2, Fe + 3, la un pH de fluide fiziologice nu sunt puternici agenți reducători. liganzi înconjoară stabilizarea ionilor în aceste oxidare.
5. Elemente de complexare sposobnostd
Abilitatea de a crea legături chimice care implică d-electroni și liberi d-orbitali cauzează o capacitate pronunțată a d-elemente în formarea de compuși complecși stabili.
La stări joase de oxidare pentru d-elemente ale unui cationic tipic, în timp ce la ridicat - complecși octaedrice anionici.
Elementele D-CN sunt deplasabile, este chiar număr de la 4 la 8, cel puțin 10,12.
Folosind neumplute d-orbitali și perechile de electroni singulară asupra d-electroni strat predvneshnem, d-elemente pot acționa ca donor de electroni - legătură dativ. și electroni acceptori.
Structura octaedrică a ionului de complexare este determinată de capacitatea orbitalii la hibridizare d2 sp3. De exemplu, pentru crom (III), d2 sp3 hibridizare este după cum urmează:
D-complexele elemente Bioinorganic la moleculele de proteine numite biocluster. Biocluster situate în interiorul cavității, în care ionul metalic este de o anumită dimensiune, dimensiunea ionului trebuie să se potrivească exact cu diametrul biocluster cavității. Metal reactioneaza cu atomii donori care leagă grupări hidroxil: -on, -SH sulfhidril, carboxil -SOO¯, proteine aminoacizi sau aminoacizi - NH2.
Biocluster, cavitățile care formează centrele de enzime, numite metaloenzimelor.
În funcție de funcția îndeplinită biocluster convențional împărțită în:
- transportul, livrarea oxigenului corpului și Biometals. Forme bune de transport m / complexe metalice utilizate AMC. Ca de metal de coordonare poate fi: Co, Ni, Zn, Fe. De exemplu - transferinei.
- acumulator. economii. De exemplu, - mioglobina și feritina.
- biocatalizatori si activatori procese inerte.
Reacțiile catalizate de aceste enzime sunt împărțite în:
Reacția acidă-bazic. anhidraza carbonică catalizează reversibil CO2 procesul de hidratare în organismele vii.
metaloenzime în care metalul se schimbă starea de oxidare reversibil catalizată.
A. anhidrazei carbonice, carboxipeptidază, alcool dehidrogenaza.
Anhidrazei carbonice - Zn conținând enzimă. enzimă din sânge se găsește în celulele roșii din sânge. anhidraza carbonică catalizează reversibil procesul de hidratare CO2, catalizează și reacția de hidroliză în care o grupare carboxil este implicat substrat.
CO2 + H2O ↔ H 2 CO 3 ↔ H + + HCO3 ¯ (mecanismul de "zinc-apă")
CO2 + ↔ asupra HCO3 ¯ (mecanism de "hidroxid de zinc")
Numărul de coordonare 4. Trei situsuri de coordinare zinc ocupate de aminoacizi, a patra apa leagă orbitale sau o grupare hidroxil.
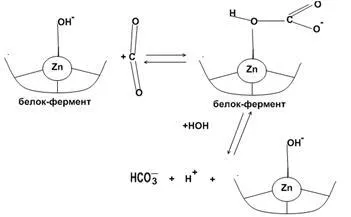
hidratarea reversibilă a CO2 în situsul activ al anhidrazei carbonice
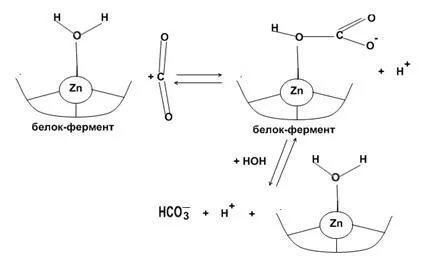
Carboxipeptidazei Zn conținând enzimă. obiecte de concentrare sunt ficatul, intestin, pancreas.
Implicată în hidroliza legăturilor peptidice.
Schema de interacțiune carboxipeptidaza zinc cu substratul ( „zinc-carbonil“):
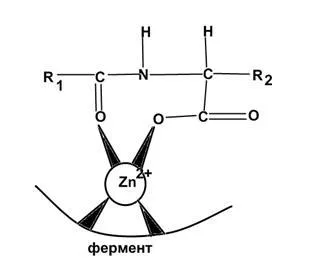
Schema de reacție de hidroliză a legăturilor peptidice karboksipetidazy:
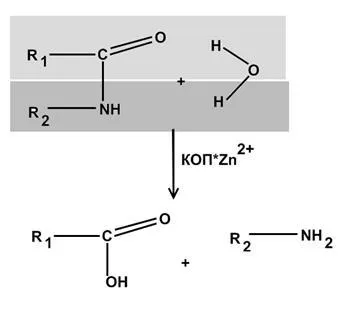
-conținând alcool dehidrogenaza este o enzimă.
B. citocromilor, catalază, peroxidază.
Citocrom C (vezi COP curs). enzimă conținând hem, are o structură octaedrice.
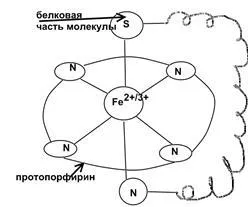
transferul de electroni într-un lanț redox cu enzima este realizată prin schimbarea stării de fier:
Biserica lui Hristos * Fe3 + + è ↔ Biserica lui Hristos * Fe2 +
grup de enzime care catalizează vodorodperoksidom reacției de oxidare numit catalaza și peroxidaza. Ei au în structura lor atom de hemului central este Fe3 +. mediu Ligand este prezentat în cazul catalazei AMC (histidina, tirozina), în cazul peroxidazei - liganzi sunt proteine. Enzimele concentrate în sânge și țesuturi. Catalaza accelerează descompunerea peroxidului de hidrogen format ca rezultat al reacțiilor metabolice:
H2 O2 + H2 O2 ↔katalaza ↔ 2 H2O + O2
Peroxidază enzimă accelerează oxidarea substanțelor organice (RH) de peroxid de hidrogen:
H2 O2 + H2O * RH ↔peroksidaza ↔ 2 H 2 O + RCOOH
SOD - superoxid dismutaza - proteină conținând cupru. Acesta accelerează reacția de descompunere superoxid ion, radical liber. Această intrare radicală în interacțiune cu stand componente distruge. SOD transformă superoxid ion într-un peroxid de hidrogen. Ceea ce, la rândul său, în organism se descompune de enzima catalaza.
Schematic, procesul poate fi reprezentat:
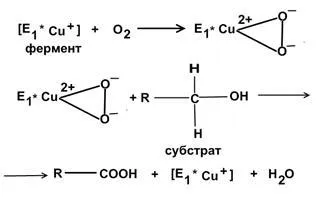
Laser - oxygenase - activarea enzimelor molecula de oxigen care ia parte la procesul de oxidare a compușilor organici. Oxigenază doi atomi de oxigen sunt atașați pentru a forma un lanțuri peroxidice.
Mecanismul oxigenaze de acțiune pot fi rezumate după cum urmează:
Citocrom oxidaza - CCO - cea mai importantă enzimă respiratorie.
Catalizează etapa finală a respirației țesuturilor. In timpul procesului de oxidare catalitică cupru starea CCO se schimbă în mod reversibil: Cu2 + ↔Cu1 +.
Forma oxidată a CCO (Cu2 +) primește electroni care se deplasează sub forma redusă (CU1 +), oxidabile cu oxigen molecular, în sine, astfel restaurat.
Apoi, oxigenul primește protoni din mediu și se transformă în apă. Schema de acțiune a CCO:
Ceruloplasmina - CPU - o proteină conținând cupru se găsește în plasmă la mamifere. CPU 8 include atomi de cupru per 1 moleculă de proteină. CPU este implicat în oxidarea fierului:
In paralel, procesul de oxidare substraturi protonate (RH) pentru a forma intermediari radicali liberi:
În același timp, procesorul catalizează reducerea oxigenului la apă:
O2 + 4E + 4H + → → 2H2O CPU
Efectuarea funcției de transport, CPU reglează echilibrul de cupru și asigură îndepărtarea excesului de cupru din organism.