Valence a elementelor - stiu cum
§6. Valenței și tipuri de legături chimice
Valența elementelor depinde de structura electronică a atomului și se manifestă numai în formarea de compuși chimici. Să considerăm, de exemplu, este format din doi atomi de hidrogen ai moleculei de hidrogen. După cum se știe, un atom de hidrogen are un e-electron. Dacă se confruntă cu doi atomi de hidrogen având electronii s cu spini antiparalele, acești nori de electroni se pot suprapune parțial reciproc, formând o pereche de electroni,
Figura 4. Schema de suprapunere reciprocă s-orbită-Leu în molecula de hidrogen
aparținând doi atomi de hidrogen simultan, care leagă ferm cei doi atomi într-o singură moleculă (Fig. 4). Când formarea legăturilor chimice este o suprapunere reciprocă a orbitalii. Perechea Convențional socializarea electron în formarea legăturilor chimice descrise după cum urmează:
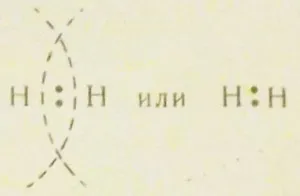
Punctele reprezintă cele două împerecheat electroni. O astfel de legătură chimică. format prin perechile de electroni comune se numește o legătură covalentă.
Totuși, legătura covalentă formată dintr-o pereche de electroni s-, are loc numai hidrogen. In alte molecule, este format în mod tipic prin două sau p-electroni, nori care au o formă dumbbell sau e - și un singur rând de electroni.
De exemplu, ia în considerare formarea moleculei de fluor F2. Un atom de fluor este pe stratul exterior al unuia nepereche electron-electron p. molecule de fluor conduce la formarea unei suprapuneri reciproce a doi nori p -electron. Convențional, acest lucru poate fi reprezentat după cum urmează:
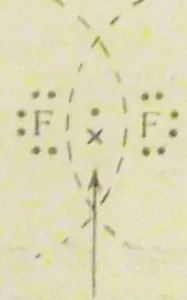
În acest caz, este finisat cu un strat extern octetul electronic al fiecărui atom. Fiecare atom de fluor 6 are propriul electron (e aparținând atât așa-shell și p) și socializat 2 și 8 electroni.
Acesta poate fi, de asemenea, cazul în care sunt socializate nu una, ci mai multe perechi de electroni. De exemplu, în formarea unei molecule de azot
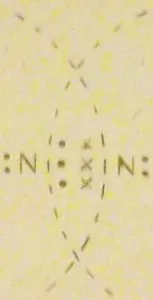
În acest caz, fiecare atom de azot are la stratul exterior 2 al propriei sale și 6 (pereche 3) electroni socializate.
Explicati legătură ■ 35. covalentă în molecula de clor Cl2. O2 oxigen. (A se vedea. Response)
Până în prezent, am considerat o legătură covalentă formată de electroni ai celor doi atomi de același nume. Cu toate acestea, mult mai des, există cazuri în care o astfel de cuplare are loc între atomii încărcați opus. De exemplu, într-o moleculă de CH4 metan apare între un atom de carbon și patru atomi de hidrogen:
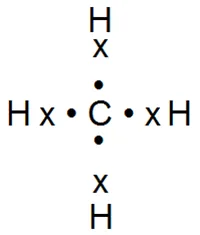
Într-o moleculă de CO2 de dioxid de carbon între cei doi atomi de oxigen și atomul de carbon:
și t. d.
Valence a elementelor din acest tip de conexiune se numește o legătură covalentă. De exemplu, carbon în molecula chetyrehkovalenten de dioxid de carbon și oxigen - dvuhkovalenten. Amploarea covalency fiecărui atom determinat de numărul de perechi de electroni formate de acestea.
Proprietăți simultan formate oppositely atomi edektrootritsatelnost legături covalente afectează diferite elemente. Atom cu o mai mare electronegativitate, cu o mai mare forță atrage comune perechi de electroni, care le determină confuzie. De exemplu, într-o moleculă de metan CH4 perechilor de electroni comune sunt compensate în centrul moleculei la un atom de carbon ca dioxid de mai electronegative, carbon în molecula - la atomii de oxigen. așteptat în mod natural să apară lângă atomii de oxigen
Figura 5. Schema de suprapunere reciprocă a formării legăturilor chimice
excesul negativ, și în apropiere atomii de hidrogen de sarcină pozitivă în exces. Cu toate acestea, datorită faptului că CH4 și CO2 molecule sunt simetrice, fenomenul de offset a perechilor de electroni nu se produce în procesele chimice. Bunicul situație, dacă molecula nu este simetrică, ca de exemplu, HCI este acid clorhidric. Legătura covalentă este formată prin suprapunerea reciprocă a s electroni nepereche nor de hidrogen și unul nepereche clor electron p-nor (Fig. 5). Toate celelalte orbite dacă electrod extern clor strat asociat. Convențional, acest lucru este indicat după cum urmează:
Cu toate acestea, clorul este electronegativitate mult mai mare decât hidrogen, astfel încât perechea de electroni a mutat puternic la clor, clorul rezultat dintr-o sarcină negativă, iar la celălalt capăt al moleculei (atomul de hidrogen) - sarcină pozitivă. Molecula este detectat ca doi poli - pozitiv și negativ. Această moleculă este numită o moleculă polară sau dipol.
Legătură covalentă, în care există o schimbare a perechilor de electroni la un atom mai electronegativ, numita legătură polară. obligațiuni Polar nu conduce întotdeauna la formarea dipol. De exemplu, în cazul
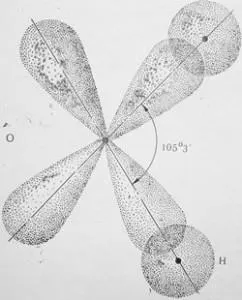
Fig. 6. Schema legăturii chimice cu unghiul de alungire 105 ° 3 „suprapunere cu s - i p orbitalii în molecula de apă
formarea de molecule de dioxid de carbon cu deplasare de perechi de electroni are loc, dar nu există nici un dipol, deoarece molecula este simetrică. Sunt molecule asimetrice polare de apă, amoniac, hidrogen sulfurat, și așa mai departe. D.
Molecula de apă este format dintr-un atom de oxigen unic având 6 electroni în stratul exterior (dintre care doi electroni nepereche la p), și doi atomi de hidrogen având unul electroni nepereche s. După cum se știe, p - orbitalii sunt aranjate în jurul miezului în plane reciproc perpendiculare la unghiuri drepte. Când formarea legăturii reciproce are loc suprapunerea p orbitalii orbitali hidrogen oxigen și s. Când acest lucru s-orbitali a doi atomi de hidrogen sunt respinse în creștere ușoară unghiul dintre p orbitalii de oxigen la 105 ° 3 „(fig. 6). Unghiul Aparuta numit unghi de valență.
Offset perechi de electroni partajate la un oxigen puternic negativ, de asemenea, duce la formarea unui dipol.
Electronii sunt implicate în legarea chimică se numesc electroni de valență. În cele mai multe cazuri, electronii de valență sunt strat electronic extern. Cu toate acestea, în formarea legăturilor chimice pot participa și electroni mai profund predvnesh-strat.
■ 36. explică formarea legăturii covalente polare în molecule HBr, H2 S. (A se vedea. Raspuns)
Frecvent, dacă diferența în electronegativitatea elementelor este suficient de mare, aceasta poate avea loc nu numai deplasarea electronilor spre un element mai electronegative, iar transferul total de electroni de la un atom la altul. De exemplu, când o legătură chimică între sodiu și clor atomi de valență de sodiu electron complet convertit la clor strat electronic extern, completând-l vosmielektronnoy structura
Astfel, un atom de clor devine o sarcină negativă în exces - 1, transformarea dintr-un atom neutru într-un ion încărcat negativ. atom de sodiu, după ce a pierdut un electron dobândește o sarcină pozitivă +1, transformarea dintr-un atom neutru ion pozitiv. ionii încărcați opus atrag reciproc prin forța de atracție electrostatică pentru a forma o moleculă de clorură de sodiu. Înregistrați acest proces poate fi după cum urmează:
O astfel de molecula numita ionic, deoarece este format de ioni. Liantul chimică în acest caz, este de asemenea, numit ionic sau electrovalent. Valența elementelor din acești compuși sunt numite elektrovalent-Ness.
legături chimice de tip ion Molecule apar în cazul în care elementele sunt conectate atomi cu diferite electronegativitate brusc - din metal tipic tipic și metaloid. Acestea pot fi elemente de la începutul și la sfârșitul perioadei.
■ 37. explica formarea unei legături ionice la moleculele de bromură de potasiu KBr, sulfura de sodiu Na2S, Mg3 N2 nitrura de magneziu. (A se vedea. Raspuns)
Nonpolar caracteristică legătură covalentă a substanțelor simple - molecule metaloid din care constau din atomi de același nume, de exemplu, Cl2. O2, N2, și așa mai departe. D.
Când este conectat la atomii, spre deosebire de nemetale căror electronegativitate este diferită, atunci în mod inevitabil, există o legătură polară. Cu toate acestea, în funcție de dispunerea spațială relativă a atomilor într-o moleculă, în general, poate fi polar sau nepolar.
De exemplu, HCl molecula polară, deoarece are un caracter liniar al moleculei de apă H2O ca polar - este plat, cu un unghi de alungire de 105 ° 3 „(Figura 7.). Amoniac ca molecula de NH3 este polară, ca are forma unei piramide triunghiulare cu azotul deasupra. Unghi Bond 108 ° (fig. 8). CH4 molecula non-polar, deoarece acesta are forma unui tetraedru cu atomul de carbon la centru. Bond unghi 109 ° 28 „(fig. 9). Astfel, polaritatea moleculei ca întreg depinde de compoziția sa și dispunerea spațială reciprocă a atomilor.
Moleculele complexe sunt adesea combinate diferite tipuri de legături chimice. De exemplu, într-un sulfat de sodiu Na2 SO4 molecula, atomii de sodiu sunt conectate la oxigen printr-o legătură ionică și sulf și oxigen - prin legătură covalentă
Astfel de exemple sunt multe.
Fig. 7, structura moleculei de apă cu Schema întindere unghi de 105 ° 3 '
Fig. 8. Structura schimbului de circuit cu molecula de amoniac
unghi de 108 °
Fig. 9. Structura circuitului a moleculei de metan la unghiul moneda 109 ° 28 '
! ■ 38. Dintre următoarele formule Iai Substanțe PSEC cu substanțe ionice, molecule polare și nepolare și explică modul în care acestea sunt construite: HBr, H2 O, CO, PH3. CaS, ZnCl2. SiH4. CCI4 (A se vedea. Response)
Alte tipuri de legături chimice (metalice, in-burly, donor-acceptor) vor fi discutate mai jos.
Crystal zăbrele.
Totul până în prezent a fost spus despre legăturile chimice dintre atomii implicate doar moleculele individuale. Dar, vorbind despre această problemă, ar fi greșit să ia în considerare numai molecule individuale, deoarece acestea nu oferă o imagine de ansamblu a problemei.
Aproape toate solidele în condiții normale sunt sub formă de cristale. Structura rețelei cristaline este numit. Acesta poate fi format ca identice sau diferite părți.
In NaCl de clorura de sodiu cristalină zabrele ionii formați Na + și Cl - (figura 10.), și de aceea este numit ion. În nodurile sale sunt aranjate alternativ ionii de sodiu și clor. Acestea sunt conectate între ele forțele de atracție electrostatică. Cristalul este ca o singură unitate.
Fig. 10. Circuitul rețelei cristaline de clorură de sodiu.
Astfel, în stare solidă (în cristale) găsim numai ionii de Na + și Cl -. Numai în stare gazoasă (în perechi) NaCl exista sub forma de molecule.
Fig. zăbrele diamant Schema 11. Atomic
Rețeaua cristalină nu poate fi formată ioni și atomi. De exemplu, în site-urile cu zăbrele cristal de diamant (Fig. 11) de atomi de carbon, grafit sau sunt conectate printr-o legătură chimică covalentă. Astfel, cristalul este ca o molecula gigant.
Figura 12. Schema rețelei de cristal de iod molecular.
O astfel de structură cristalină numită atomic.
Formula substanță simplă înregistrată I2 iod, subliniind faptul că molecula de iod este format din doi atomi. Siturile zăbrele aranjate moleculele de iod I2 (fig. 12), astfel încât aceasta se numește rețea cristalină molecular.
zăbrele cristalin molecular poate fi format nu numai molecule de substanțe simple, dar complexe, cum ar fi dioxidul de carbon (sub formă solidă de „gheață uscată“), apă (sub formă solidă de gheață), și așa mai departe. D.
Dintre toate tipurile de barilor de cristal moleculare - cele mai fragile, așa cum sunt deținute numai în detrimentul forțelor atractive intermoleculare fără participarea energiei legături chimice. Cel mai stabil zăbrele - putere nucleară, în cazul în care există o legătură covalentă.
■ 39. De ce temperatură de topire a apei cu mult sub temperatura de topire a carbonului?
40. După cum este posibil, știind că punctul de topire și alte proprietăți fizice ale materialului ajuns la concluzia cu privire la natura rețelelor cristaline?
41. Care este diferența dintre latici ionice, atomice si cristal molecular? (A se vedea. Response)
§ 7. Determinarea folosind tabelul periodic al elementelor și valența oxizi superioare cu formulele
Sistemul periodic al elementelor permite poziției în cadrul acesteia a unui element găsit formula compușii săi cu alte elemente pentru a determina natura legăturii chimice în moleculele lor și proprietățile lor.
Numărul grupului din tabelul periodic este numeric egală cu cea mai mare valența oricărui membru al acestui grup în compuși cu oxigen. De exemplu, sulf, un element de grup VI, este de 6 până la elementul de fosfor din grupa V - 5, stronțiu, element din grupa II - 2. Pe baza teoriei structurii atomice este ușor explicabilă. strat de electroni extern al acestor elemente este, respectiv, 6, 5 și 2 de electroni de valență. Atunci când sunt combinate cu elemente mai electronegativ, cum ar fi oxigenul, este format ca legături de valență ca exista valență electroni. Electronii schimbat foarte mult spre atomul cel mai electronegativ (de exemplu, SO3. P2 O5) și uneori (în formarea de legături electrovalent) și complet detașat și transferat la acesta din urmă compuși, determinând astfel ca oxizi superior SrO, Na2 O și t. d.
valență mai mare în compuși cu oxigen, care este numeric egal cu numărul grupului, prezentând elementele nu numai grupul principal, dar, de asemenea, partea, în ciuda faptului că pe stratul de electroni exterior al atomilor este cel mai adesea 1 - 2 electroni, indiferent dacă acestea sunt într-un grup . De exemplu, bine cunoscut oxid Mn2 O7. unde mangan valență (Grupul elementul VII) este egal cu 7, în ciuda faptului că stratul exterior de electroni 2 are un electron atom de mangan. Vanadiu (V element de grup) în oxid de top V2 O5 prezintă o valență de 5, deși stratul de vanadiu electronic extern are doar doi electroni. Acest lucru se datorează faptului că legarea chimică implică nu numai electronii din stratul exterior, dar plicul electronic predvneshnego, care nu este pe deplin construit. Cu toate acestea, pentru procesul de a se angaja în electronul strat mai profund nevoie de multă energie, prin urmare, astfel de compuși sunt, în general, mai dificil de a percepe.
■ 42. Care este cea mai mare valența în compuși cu elemente de oxigen niobiu, galiu, technețiu?
43. Care este cea mai mare valență în compuși cu elemente de oxigen staniu, antimoniu, taliu?
oxizi 44. Formula Scrieți mai mari de cadmiu, galiu, hafniu.
45. Scrieți o formulă de oxizi de azot mai mare, carbon, litiu.
Profitând sistemului periodic al elementelor, este posibil să se determine natura proprietăților oxidului milioane unui element și hidroxidul de formula. Pentru a putea să-l identifice pe tabelul periodic al elementelor, unul trebuie să știe modul în care acestea sunt clasificate și proprietățile sunt tipice pentru ei. (A se vedea. Response)