Proprietăți alcaline Matelli, lecții de la distanță
- De ce sunt aceste metale sunt numite „alcaline“?
- Când se dizolvă în apă, ele formează alcaline.
- Și ce este alcalin?
Dacă nu sunteți în laborator și nu intră în contact direct cu substanțe diferite, aceste concepte sunt foarte abstracte ... mi-am dat seama conceptul de „leșie“, atunci când la 1 an în laborator a șters „săpun“ pe mâini de baie sintetică și 2 minute găsite la aceste site-uri găuri! 🙂
Alkali - săpun la atingere, mai degrabă substanțe caustice. Ele sunt foarte higroscopice (trage de umiditate). Pe efectele asupra pielii, acestea sunt similare cu acidul - doar erodează și schipyat (dacă este concentrat).
Dar, înapoi la metale.
Pentru a începe, ia în considerare
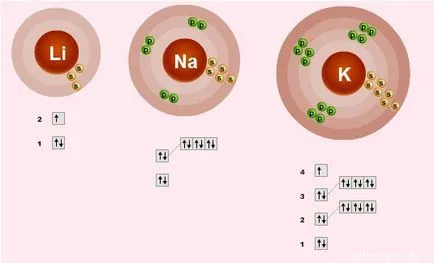
structura cojile de electroni
Structura electronică a stratului exterior al tuturor acestor elemente sunt la fel - este doar un singur electron nepereche pe s-subnivel:

Ce înseamnă acest lucru?
- = elemente Valence 1. adică fiecare atom poate forma o legătură 1.
- Gradul de oxidare a elementelor 1 = + - proprietati metalice - capacitatea de a dona electroni
- De sus în jos în subgrupei crește raza atomică, prin urmare, mai slabă electron este atras de nucleul atomului, deci, proprietăți în jos metalice crește - Fr metalic mai puternic decât Li.
- Ca o consecință, de sus în jos într-un subset de proprietăți îmbunătățite de restaurare.
Proprietățile fizice ale metalelor alcaline
- toate alb-argintiu culoare (Cs - galben)
- moale ca plastilina,
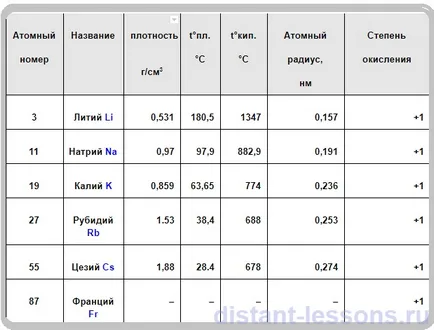

Li - în roșu
K - în purpuriu
RB - în roșu-brun
Cs - roșu și violet
- conductivitate electrică și termică
Proprietățile chimice ale metalelor alcaline
Este logic să se ia în considerare proprietățile chimice ale Clasificării de masă a compușilor anorganici.
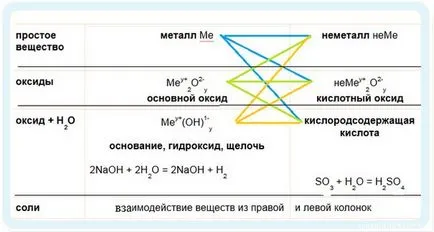
1. Continuăm săgețile în albastru
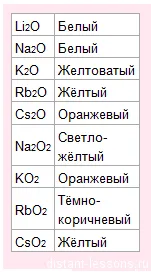
Cu oxigenul formează oxizi, peroxizi și superoxid de diferite culori:
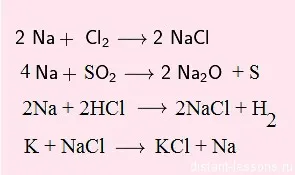
În reacțiile cu okislitelyamivodorod kislotami- nu alocate:

Notă ultima reacție - reacția sării de metal:
Nu orice metal poate începe o astfel de reacție!
Solubilitate Tabel (este în orice manual de la mijloc la chimie), la partea de jos există o linie:
Această serie de activitate electrochimica a metalelor. Noi nu vom investiga în detaliu esența seriei, și ia-o regulă:
în acest rând fiecare element anterior se poate deplasa după aceea o sare a acestuia
2. Du-te pe o săgeată verde - oxizi de reacție
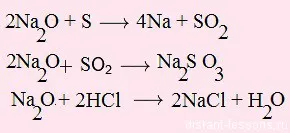
3. Mergem pe săgeata portocalie
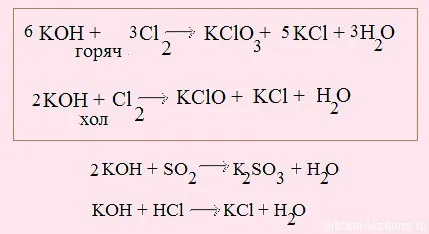
Notă primele două reacții - acestea sunt alocate în cadru. În prima reacție folosește alcalină fierbinte - oxidare se duce la +5 grade de oxidare clor. Atunci când se utilizează clor alcalin rece oxidat numai la +1.
Reacția cu un acid alcaline numita reacție de neutralizare. Două substanțe corozive puternice se neutralizează reciproc pentru a forma apa.
3. Separat, este necesar să se selecteze reacția unui metal alcalin cu hidrogen.
Așa cum am spus, de sus în jos într-un subgrup al proprietăților metalice ale elementelor de creșteri. Hidrogenul deși și stocate în primul grup, prin reacția cu metale alcaline vor prezenta o stare de oxidare negativă. S-a obținut cu hidrurile:
Toți compușii metalelor alcaline sunt ușor solubili în apă.
Acest lucru înseamnă că singura modalitate de a determina calitatea - este culoarea flăcării și a oxizilor de culoare. Nici precipitarea compușilor nu formează.
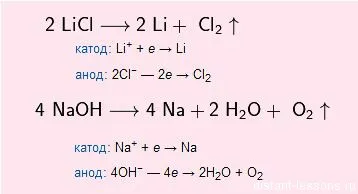
De obicei metalele alcaline prin electroliza topiturilor sau săruri alcaline ale acestuia:
NaCl (electroliza) → Na + Cl2