Principalii parametri ai statului - studopediya
Cantitățile fizice ce caracterizează starea sistemului PA se numește parametrii AP. Principalii parametri sunt temperatura, presiunea și volumul specific. Acestea includ, de asemenea, energia internă, entropia, entalpie, și altele.
Parametrii termodinamici care nu depind de mărimea și greutatea sistemului, numit parametrii de intensitate. Această presiune, temperatură și volum molar specific, iar energia internă specifică mol, și entalpia specifică molară, iar entropia specifică mole și colab.
Parametrii termodinamici proporțional cu cantitatea de material sau greutatea sistemului, numit extensiv. Acestea includ în masă, volum, energie internă, entropia, entalpie, și altele.
Corpul care constituie sistemul termodinamic poate fi într-una din cele trei stări: lichidă, solidă sau gazoasă. În conformitate cu diferite condiții și starea unuia aceluiași organism pot fi diferite. Cu toate acestea, în aceleași condiții ale corpului vor fi întotdeauna în aceeași stare. De exemplu, la presiunea atmosferică și la o temperatură de 500 ° C, apa va fi numai sub formă de vapori, dar nu lichid sau solid. Pentru a determina condițiile fizice în care se consideră corpul, cât și pentru o determinare lipsită de ambiguitate a stării sale sunt administrate de stare caracteristici - parametrii de stare.
Volumul - dimensiunile geometrice ale corpului. pentru că gaz tinde să ocupe întregul volum oferit de el, volumul de gaz este dimensiunile geometrice ale vasului în care este plasată. Sistemul Internațional de Unități de volum măsurat în m 3 unități derivate sunt de litri, cu 1000 l = 1 m 3.
Cantitatea specifică a substanței - un volum ocupat de o unitate de masă a unei substanțe date. Volumul specific v este asociat cu substanța de masă m și ei raport de volum V:
Dacă V expres în m 3 și m în kg, care v este exprimat în m 3 / kg.
Reciproca volumului specific, numit densitatea (r). Sensul fizic al densității - este greutatea unui metru cub de gaz.
Unitatea de densitate este SI kg / m 3 în sistemul cgs - g / cm3.
Densitatea și volumul specific în funcție de temperatură și presiune, adică din starea termică a materialului.
Cantitatea de substanță - este cantitatea fizică definită de un număr de elemente structurale. Unitatea de cantitate de substanță din Sistemul Internațional de Unități este cârtița.
Mol - o cantitate de substanță care conține același număr de elemente structurale (atomi, molecule, ioni, electroni, etc.) ca atomii conținute în 0,012 kg de carbon-12 izotop.
Molara (mol) volum - volumul ocupat de 1 mol de gaz. Această valoare este definită ca raportul dintre volumul substanței cantitatea acesteia.
unde Vm volum -molyarny, V - volumul, n - cantitatea de substanță.
Volumul Molar exprimat în m3 / mol.
Masa moleculară este masa substanței din 1 mol de substanță. Acesta este legat de masa substanței și a raportului cantitativ:
unde m - masa molară, exprimată în kg / mol.
Presiune - fizic cantitatea este numeric egal cu componenta forță normală în raport cu suprafața pe care acționează forță.
pentru că pentru gaz constând dintr-un număr mare de molecule care se deplasează în mod haotic este imposibil să se determine componenta normală, care utilizează adesea mai simplă presiune definiție: presiune - o forță cu care moleculele lovesc peretele vasului, în care este închisă de gaz.
Unitatea de presiune în sistemul SI este Pascal (Pa), - presiunea cauzată de o forță de 1 N, distribuite uniform pe suprafața de 1 m 2 (1 Pa = 1 N / m2). În alte sisteme, măsurarea presiunii este, de asemenea, măsurată în mmHg mmAq, bare, atmosferele × kg / cm2, etc.
presiune de conversie Tabelul este prezentat în apendicele 1.
Distinge atmosferică (barometrică) Ratm presiune. Manpower absolut. ecartament (ecartament) Rizb. subpresiunea (vacuum) Rvak.
Presiunea absolută se numește presiune măsurată de la (vid absolut) zero.
Atmosferică (barometric) numită presiunea generată de aerul atmosferic. Acesta este măsurată printr-un barometru.
Excesul (ecartament) presiuni mai mari de presiune atmosferică se numește, adică suprapresiune - diferența dintre presiunile absolute și barometrice:
presiune excesivă măsurată cu ajutorul unui manometru.
Aspirație sau presiune de vid este diferența dintre presiunea atmosferică și presiunea absolută a mediului în care se măsoară presiunea.
vid presiune este măsurată printr-un manometru de vid.
Ecuațiile termodinamice este întotdeauna valoarea presiunii absolute, datorită faptului că acesta este un parametru care caracterizează starea sistemului.
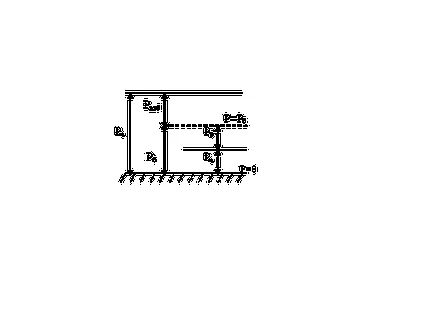
Figura 1. Tipuri de presiune.
Presiunea atmosferică - o variabilă, astfel încât presiunea atmosferică normală este aplicată în domeniu. P0 = 101325 Pa (760 torr sau 1 atm).
Moleculara - Teoria cinetică a gazelor permite stabilirea comunicației între presiunea și energia cinetică a mișcării termice a moleculelor de gaz. Conform acestei teorii, care consideră că se presupune un gaz ideal care moleculele de gaz sunt distribuite uniform în volumul și un număr enorm stocat în mișcare termică haotic. Molecule continuu afecta unul pe altul și pe pereții vasului, în care gazul închis. Ca urmare a ciocnirilor moleculelor presiunii peretelui este creat normal suprafețe de perete și uniform în toate direcțiile.
presiunea gazului de absolută se determină prin formula:
,
unde n - numărul de molecule pe unitatea de volum;
m - masa într-o moleculă de gaz omogen, pentru toate moleculele de același lucru este adoptat;
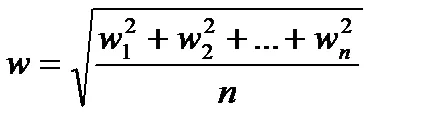
Valoarea definește energia cinetică medie a mișcării de translație a unei molecule.
Temperatura - măsură corp încălzit. Temperatura determină direcția de transfer de căldură. Dacă două corpuri A și B au respectiv temperatură T1 și T2 și T1> T2. căldura este transferată în mod spontan din corpul A și corpului B. o scade temperatura corpului și a temperaturii B - creșterea.
Pentru a judeca aceleași sau diferite temperaturi ale celor două corpuri A și B nu este necesar pentru a le aduce în contact termic unul cu celălalt. Acesta poate fi utilizat pentru acest al treilea rând corp C acționat în contact cu corpurile A și B. Se numește corp la termoscop.
Pentru determinarea cantitativă a temperaturii corpului utilizând scala de temperatură. Calibreze cu privire la orice regulă termoscop se transformă într-un termometru. și anume un dispozitiv pentru măsurarea temperaturilor.
O citire numerică a temperaturii produsă prin scala de temperatură. În prezent, sunt utilizate diferite scale: Kelvin, Celsius, Fahrenheit, Reaumur, Rankin.
Decizia Comitetului Internațional de Măsuri și Greutăți a adoptat două scări: scara de temperatură termodinamică, care a adoptat scara de bază, practice și internaționale (IPTS-68), selectate astfel încât temperatura măsurată pe această scală a fost aproape de a termodinamicii (foloseste grade Celsius).
Cel mai versatil este absolut termodinamice scala de temperatură - scara Kelvin.
Temperatura ambelor scale pot fi exprimate în grade Kelvin și grade Celsius. Raporturile dintre aceste temperaturi următoarele:
Din punct de vedere molecular - teoria cinetică a temperaturii este o măsură a intensității mișcării termice a moleculelor. Valoarea sa numerică este legată de energia cinetică medie a moleculelor dintr-o substanță. Pentru un gaz ideal, această relație funcțională este definită de ecuația:
,
unde k - constanta Boltzmann (k≈1.3806 · 10 -23 J / K).
Temperatura T, astfel definită, se numește absolută. În consecință, în considerarea termodinamica temperaturii ca valoare medie statistică care caracterizează un sistem format dintr-un număr mare de molecule într-o mișcare haotică (termică). Prin urmare, la molecule unice ale conceptului de temperatură nu este acceptabilă. Din această din urmă expresie arată că valoarea T = 0 corespunde w = 0; la temperatura absolută zero, mișcarea termică a moleculelor este absent. Această limitare a temperaturii se numește minim zero absolut și este punctul de plecare pentru temperatura de referință. Se înțelege că nu poate fi T <0, т.е. абсолютная температура всегда положительна.
Raportul dintre diferitele scale sunt prezentate în apendicele 2
Presiunea absolută și temperatura absolută sunt interdependente
unde k - Boltzmann egală cu 1.3806 x 10 -23 J / K
n - concentrația moleculară (numărul de molecule pe unitatea de volum).
Această ecuație se numește ecuația fundamentală a teoriei cinetice a gazelor.