pisicuta Lecture cu carbon
Acizii carboxilici sunt compuși organici ale căror molecule conțin una sau mai multe grupări funcționale carboxil conținând oxigen - COOH.
După numărul acestor grupuri se disting una, două, trei sau mai mult acid bazic.
Formula generală a acizilor monocarboxilici aciclici seria R-COOH, aromatic - Ar-COOH, unde R- saturați și radicalii nesaturați în limita serie (saturate) și acizi nesaturați (nesaturați) carboxilici, Ar - fenil radical - C6 H5.
Limitarea acidului monobazic
Denumirile acizilor carboxilici simplu este adesea asociat cu sursele din care au fost izolate pentru prima dată: acid formic din furnici, acidul acetic, oțet, etc. carboxilic mai sofisticate pot fi considerate ca derivați ai acidului acetic și apel pentru nomenclatură rațională.
Prin denumiri sistematice de nomenclatură produc acizi carboxilici din hidrocarburi saturate (nume cu același număr de atomi de carbon), suplimentat cu acid -ovaya închidere și cuvinte. Lanțul principal este numerotat din carbonul grupării carboxil.
Izomerie acizilor carboxilici depinde de structura scheletului de carbon asociat cu gruparea carboxil.
Cele mai importante metode generale pentru prepararea acizilor carboxilici sunt:
1) Limita de oxidare (parafinic) hidrocarburi cu aer sau oxigen tehnic la temperaturi ridicate în prezența, ca regulă, catalizatori:
2) reacția olefinelor cu monoxid de carbon (P) și aburul pentru a obține:
3) oxidarea alcoolilor primari, aldehide, cetone:
4) sinteza prin intermediul compusului organometalic și CO2:
5) Hidroliza (saponificare), nitrili (R-C = N):
6) saponificarea esterilor:
Proprietățile chimice ale acidului carboxilic
Multe dintre proprietățile de acid carboxilic, datorită prezenței în moleculele lor o grupare carboxil este puternic polarizată. Astfel, atomul de oxigen legat la o dublă legătură carbon este mai electronegativ trage electroni π-conexiune, care conduce la formarea unei sarcini negative asupra oxigenului. atom de carbon, obtinerea unele sarcina pozitiva atrage perechea de electroni liberă a atomului de oxigen al grupării -OH. Acest lucru duce la deplasarea și atenuarea comunicare σ-oxigen-hidrogen și să manifeste un caracter pronunțat de acid al acizilor carboxilici.
Soluțiile apoase ale acizilor carboxilici disociază în ioni, cum ar fi acizi minerali pentru a forma ioni hidroniu:
Gradul de disociere (ionizare) și, în consecință, forța datorită cantității de acid carboxilic și natura radicală, precum și influența substituenților situate în apropierea grupării carboxil.
Substituenții cum ar fi -OH, -Vg, -C1, -NH2. -NO2, -COOH, -SOOR (prezintă efect inductiv negativ -Ief) crește tăria acizilor, alții - radicali de hidrocarburi (IEF +) - reduce gradul de disociere. Intr-adevar, gradul de disociere a acidului cloracetic (III) este de aproximativ 10 ori, și oxalatul (II) în 50 de ori mai mare decât acetic (IV) de acid. acid tricloracetic (I), prin gradul de disociere comparabil cu acizi minerali.
Acizii organici formează numeroși derivați funcționali ai grupărilor carboxil σ-PR, și anume:
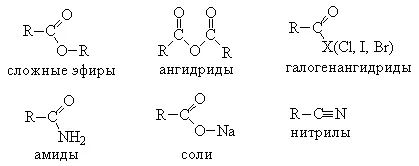
2. Formarea sărurilor. Acizii carboxilici au toate proprietățile acizilor convenționali. Ele reacționează cu active metal Lamy, oxizi de bază, săruri de baze slabe și Lot pis:
RCOOH + NaOH → RCOONa + H2O,
Acid carboxilic - slab, cu toate acestea, acizi minerali puternici repoziționează-le din sarea lor respective:
CH3 COONa + HCI → CH3COOH + NaCI.
Săruri ale acizilor carboxilici în soluții apoase de hidrolizată:
CH3 COOK + H2O CH3COOH + KOH.
Spre deosebire de acidul carboxilic mineral este posibilitatea formării unui număr de derivați funcționali.
3. Formarea derivaților funcționali ai lot pis carboxilic. Prin substituirea grupelor OH în diferite grupe de acizi carboxilici-TION (X) sunt formate derivații funcționali ai acizilor având formula generală R-CO-X; aici R este o grupare alchil. Deși alte nitrili au formula generală (R-CN), în mod normal, ele sunt de asemenea considerate ca fiind un derivat al acidului carboxilic de rasă, deoarece acestea pot fi preparați din acești acizi.
clorură de clorurile obținut prin acțiunea de fosfor (V) Acid pentru:
R-CO-OH + PCI5 → R-CO-Cl + POCI3 + HCI.
HCOOH Acid formic are un număr de caracteristici ca în componența sa are o grupare aldehidă:
Acid formic - un puternic agent reducător și ușor-oxizi doresc să stabilească până la CO2. Acesta dă reacția „oglindă de argint“:
sau într-o formă simplificată:
În plus, acidul formic este oxidat de clor:
Acidul carboxilic atmosferă de oxigen oxidat la CO2 și H2O:
6. Reacția decarboxilare. Acid monocarboxilic saturat nesubstituit datorită rezistenței ridicate a C-C decarboxilat prin încălzire cu dificultate. Pentru acest q.s. Dimo sare de metal-fuziune alcalin a unui acid carboxilic cu un alcalin:
Acid monobazic Nesaturați.
Acid monobazic nesaturată includ hidrocarburi nesaturate radical legat la gruparea carboxil.
Formula generală a acestor acizi cu o legătură dublă CnH2n-1 COOH. Molecula de acizi carboxilici nesaturați pot conține două sau mai multe legături etilenice, precum și o triplă legătură. Exemple de astfel de acizi sunt: acidul acrilic, CH2 = CH-COOH, acid acrilic metil, CH2 = C (CH3) -COOH, acid crotonic CH3-CH = CH-COOH, acid sorbic, CH3-CH = CH-CH = CH-COOH, propiolic CH≡C-COOH acidă și acizi nesaturați superiori (oleic, linoleic și acidul linolenic).
Izomeri acestor acizi este hidrocarburi nesaturate izomerie similare.
Acid acrilic CH2 = CH-COOH, care conține trei atomi de carbon nu are izomeri și acizi nesaturați cu patru atomi de carbon are trei izomeri:

acidul crotonic, în plus, pot exista ca izomeri geometrici (cis doi-trans):
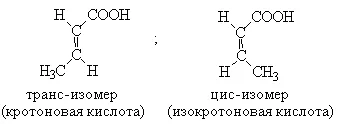
Nomenclatorul acestor acizi este asociat în principal cu nume triviale. În conformitate cu nomenclatura sistematică a numelor lor formează numele hidrocarburilor nesaturate corespunzătoare și sfârșitul -ovaya:
Noțiuni de bază. Acizii monobazici nesaturati pot fi preparați prin următoarele metode.
1. Introducere în compuși care conțin legături duble, carboxil:
2. Introducerea unei duble legături într-un compus care conține o grupare carboxil:
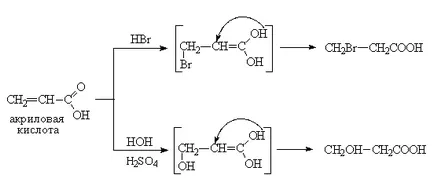
Proprietățile chimice ale acizilor monocarboxilici nesaturați sunt determinate printr-o dublă legătură și o grupare carboxil. Prin urmare, acizii nesaturați pot prezenta proprietăți ca un acizi convenționali și compuși nesaturați. Astfel, ele intră în reacția de adiție, oxidarea și polimerizarea. Cu toate acestea, o grupare carboxil, fiind un acceptor de electroni puternic, reduce legătura dublă a activității (depletes densitatea de electroni) în reacțiile compușilor electrofile. De aceea, atașarea halogenuri de hidrogen la acizi carboxilici nesaturați având legături duble conjugate etilenice și (α, acid β nesaturat) și tipul lor de hidratare sunt 1,4-plus (regula anti-Markovnikov).
dicarboxilic sau dibazic, marginal (alkadiovye) și acid nesaturat (alkediovye).
Dibazic sau dicarboxilici, acizi conțin în moleculă gruparea carboxil a doua: HOOC-R-COOH.
În funcție de natura diacizii R radicali pot fi saturate și nesaturate.
Nomenclatura. Acizii din seria de multe ori au nume comune, de exemplu:
HOOC-CH2-COOH - malic
În conformitate cu nomenclatura sistematica a acizilor dibazici nume este din hidrocarburile corespunzătoare și titlurile finale
cuvinte -diovaya sau acid dicarboxilic:
Izomerie limitarea acizilor dicarboxilici depinde de structura lanțului de carbon la care sunt conectate două carboxil, nesaturat și - poziția dublei legături în lanț. In plus, diacizi nesaturați, monohidrici nesaturați cum ar putea exista ca doi geometrici (cis și trans) izomeri. De exemplu, cea mai simplă de nesaturat HOOC-CH = CH de acid dibazic-COOH (etilen-1,2-dicarboxilic) existentele sub forma trans (acid fumaric) și forma cis (acid maleic):

Metode de obținere în acizi dibazici principiu nu diferă de metodele de preparare a monobazic. Cu toate acestea, în prepararea lor ca materie primă se utilizează un compus cu două grupări funcționale convertibile la carboxil:
Proprietățile chimice ale acizilor dicarboxilici definite prin prezența în moleculă, două grupe carboxil și în cazul acizilor dibazici nesaturați, de asemenea, o legătură dublă. Influența grupului Carboxilul reciproc, crește proprietățile acide ale acestor acizi. Cel mai puternic dintre acizii dicarboxilici sunt acidul oxalic (este mult mai puternic, de exemplu, acid acetic).
Proprietățile chimice ale acizilor dibazici, este în mare măsură similară cu proprietățile monobazic. Ele formează săruri, esteri, cloruri acide, etc. Cu toate acestea, având două grupări de acid carboxilic, acestea de acid capabil să formeze două serii de derivați: mediu acid și săruri, esteri ai acizilor și medii etc ..
Acizii dicarboxilici și au proprietăți specifice care depind de influența reciprocă a celor două grupe carboxil. Astfel, în timpul descompunerii termice, ele formează diferite produse, natura care este determinată de carboxilii poziție reciprocă. Acid, în cazul în care aceste grupări sunt adiacente (1,2-poziție) sau dispusă printr-o grupare metilen (1,3-poziție), atunci când este încălzit peste temperatura de topire decarboxilare sunt supuse:
Un reprezentant important al unui număr de limitare acid dicarboxilic acționează ca acid adipic HOOC- (CH2) 4-COOH. Când condensarea cu N- hexametilen diamină H2 (CH2) 6 -NH2 formeaza un compus macromolecular - poliamida, care este fabricat dintr-o -naylon din fibre sintetice (anide).
Nylon (nylon-66, poliamida 66 - Engl nylon nylon;. Nylon-6, nylon 6 - nylon) - poliamidă sintetică utilizată în mod avantajos în producerea de fibre.
Există o teorie că cuvântul „nylon“ este derivat din numele orașului New York și Londra (NYLON = N ew Y ork + Lon Don). De asemenea, există un aviz, care este cuvântul - o abreviere de la New York, Laboratorul de Nitrocompounds organice. Cu toate acestea, informații fiabile cu privire la acest lucru. În dicționar Webster spune că acest lucru a inventat în mod artificial cuvânt.
Există două forme izomerice nailon: anide (nylon-66) și nylon (nylon-6).

Fig. Capron 1. (de mai sus) și nylon-66 (partea de jos).
Nylon are următoarele caracteristici: