izoforme lactat dehidrogenazei
Cauzele care conduc la o creștere a numărului de enzime din sânge
Enzime de plasmă din sânge pot fi împărțite în 2 grupe. În primul rând, un grup relativ mic de enzime este secretat în mod activ în plasma sanguină a anumitor organe. De exemplu, ficatul sintetizeaza precursori inactivi ai enzimelor de coagulare. Al doilea includ un grup mare de enzime eliberate din celule în timpul funcționării normale a acestora. In mod normal, aceste enzime îndeplini funcția lor în interiorul celulei și nu au nici o semnificație fiziologică a plasmei. Într-o persoană sănătoasă activitatea acestor enzime în plasmă suficient de scăzute și constante, deoarece raportul ratelor de eliberare constantă a celulelor și ratele lor de distrugere.
In multe boli este deteriorarea celulelor și conținutul lor, inclusiv enzimele care sunt eliberate în sânge. Motivele pentru care provoacă eliberarea conținutului intracelular în sânge, transporta o permeabilitate a membranei celulare violare (procese inflamatorii), sau încalcă integritatea celulei (necroză). Determinarea activității de sânge a unor enzime este bine stabilit în laboratoarele biochimice care sunt utilizate pentru diagnosticarea bolilor de inima, ficatul, mușchii scheletici și alte țesuturi. Nivelul activității enzimei în plasmă este corelată cu gradul de afectare celulară.
Pentru enzimodiagnostiki sunt cunoștințe importante de localizare subcelulară a enzimelor. Astfel, apariția enzimelor plasmatice sanguine având doar localizarea citosolică, indicativ al procesului inflamator; detectarea enzimelor mitocondriale sau nucleare se poate vorbi despre celulele leziuni mai profunde, cum ar fi necroza.
Cu toate acestea, creșterea concentrației de enzime nu este întotdeauna asociat cu leziuni tisulare. Atunci când proliferarea excesivă a celulelor, cum ar fi procesele onkoproliferativnyh la rata sintezei crescute a anumitor enzime din celule sau clearance afectata (capacitatea vpyuditsya rinichi), se observă o creștere a concentrației sanguine a anumitor enzime. Medicii ar trebui să țină cont de faptul că valorile normale ale activității enzimei în sângele copiilor și a femeilor gravide diferă de cele tipice pentru adulți sănătoși.
Enzime care catalizează aceeași reacție chimică, dar diferă în structura primară a proteinei numite izoenzime sau izoenzime. Ele catalizează același tip de reacții cu esență același mecanism, dar diferă unul de altul parametri cinetici, condițiile de activare, caracteristici apoenzimei datorate și coenzima.
Natura apariția izoenzime a variat, dar cel mai adesea cauzate de diferențele în structura genelor care codifică aceste izoenzime. În consecință, izoenzime diferă în structura lor primară a moleculei de proteină și, în consecință, prin proprietățile fizico-chimice. Pe diferențe în proprietățile fizico-chimice metode pentru determinarea izoenzimelor pe bază.
În structura sa izoenzime sunt predominant proteine oligomerice. Și unul sau altul tesatura sintetizeaza în principal, anumite tipuri de protomer. Ca rezultat, anumite combinații ale acestor enzime protomers formate cu diferite structuri - formă izomerică. Detectarea formelor enzimatice specifice izoenzimei permit utilizarea acestora pentru diagnostic.
Glicogenul fosforilaza. enzimatice și izoenzime markeri suplimentari în diagnosticul infarctului miocardic biochimisti clinice determina activitatea si GF GF-BB izoenzime. GF - enzimă citosolică care catalizează scindarea glucozei in celula din glicogen.
În țesuturile umane, există trei GF izoenzima: GF-LL în ficat, GF-MM în miocite și SP-BB în țesutul cerebral. În miocardul uman prezent-BB izoenzimele GF și GF-MM, miocitele în mușchii scheletici - numai GF-MM. GP-BB - testul cel mai sensibil pentru diagnosticul de infarct miocardic în primele 3-4 ore dupa un atac de angină pectorală. Conform sensibilitatea diagnosticului în primele ore ale activității GF definiție poate fi comparată doar cu definiția sângelui CK-MB în masă. La majoritatea pacienților, nivelurile GF-BB a crescut semnificativ după 4 ore de la debutul angina pectorala si infarct miocardic la pacienții cu revenire fără complicații la normal în decurs de 48 de ore.
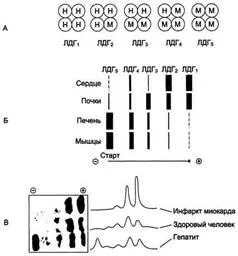
Lactatul - proteina oligomer având o greutate moleculară de 134.000 D, format din patru subunități ale două tipuri: M (din engleză, mușchi - mușchi) și H (din limba engleză, inima - inima). Combinația acestor subunități stă la baza formării 5 izoforme de lactat dehidrogenază (Fig. 2-35, A). LDG1 LDG2 și sunt cele mai active în mușchiul cardiac și rinichii, și LDG5 LDG4 - în mușchii scheletici și ficat. În alte țesuturi, există diferite forme ale acestei enzime.
Dehidrogenaza (LDH) catalizeaza reversibil lactat reacției de oxidare (acid lactic) la piruvat (acid piruvic).
Un important pas înainte este studiul izoenzimelor LDH. Cunoscut cinci izoenzime ale LDH. Ele sunt numerotate în funcție de rata de migrare în timpul electroforezei. Primul este numit cel mai rapid, iar al cincilea - cel mai încet izoenzima. Pentru fiecare caracteristică corporală a unui anumit raport de izoenzimele LDH - așa-numitul profil izoenzima sau LDH spectru. In timp ce practic fiecare organ conține toate cele cinci izoenzime, profilul lor este destul de specific și stabil. De exemplu, în inima LDG1 conținute în principal în plămâni - și LDG3 LDG2 în ficat - și LDG4 LDG5.
În infarctul miocardic acut în ser crește în primul rând activitatea LDH, care nu este doar mai devreme, specifice, dar, de asemenea, testul mai sensibil de necroză miocardică acută, așa cum este adesea determinată la acei pacienți la care LDH totale nu a depășit limita superioară a valorilor normale.
Profilul izoenzima Investigarea LDH seric, nu numai că mărește în mod semnificativ valoarea de informații a acestui test în diagnosticul diferențial între infarctul miocardic și alte forme de boli ale arterelor coronare, dar, de asemenea, vă permite să specificați diagnosticul de infarct miocardic acut în aritmia de fundal sau pericardită, după cardioversie, iar dacă există alte complicații.
- izoforme LDH diferă în mobilitatea electroforetică, care permite țesutului aparținând izoforme de LDH.
- Apariția în evoluția diferitelor izoforme ale LDH datorită particularităților metabolismului tesutului oxidativ. Izoenzime LDG4 și LDG5 (tip M LDH) funcționează eficient în condiții anaerobe, LDH și LDG2 (tip-H) - aerobioză când piruvatul este oxidat rapid la CO2 și H2O, și nu a redus la acid lactic.
- O serie de boli a examinat activitatea LDH în plasma sanguină. In mod normal, activitatea LDH este 170-520 U / l. Activitatea crescută a fost observată în leziunile acute ale inimii, ficat, rinichi, precum anemia megaloblastică și hemolitică. Cu toate acestea, indică o deteriorare a doar una dintre aceste țesuturi.
izoforme studiu diagnostic diferențiale ale LDH în plasma sanguină prin electroforeză. Cifra prezentată în plasma de sânge uman sănătos electroforetograma, pacienții cu infarct miocardic și pacienții cu hepatită. izoforme Identificarea plasmei sanguine tkanespetsifiches-CAL de LDH a fost folosit ca un test de diagnosticare a leziuni tisulare. Multe alte boli în care a crescut activitatea totală a LDH pot fi diferențiate cu succes de infarct miocardic acut, deoarece caracterizat printr-o creștere a activității din cauza izomeazitov lent. Dacă în continuare pe un astfel de fundal dezvoltă un infarct miocardic, aceasta poate fi determinată să crească LDG1 fracție, chiar dacă activitatea sa în ansamblu nu a fost modificată.
De interes special sunt rezultatele unui studiu al spectrului de izoenzime CK. Creșterea activității CPK în sânge dovezi de afectare miocardică.
Studiul activității enzimatice a metodei -perspektivny sângelui evaluare cantitativă intravital de necroză miocardică. În acest scop, definirea activității enzimatice a CK. enzimă totală care intră în fluxul sanguin din zona necrozei poate fi determinată în studiul activității sale în seria de probe de sânge pe baza modelului dezvoltat, ținând cont de viteza de ieșire a enzimei de necroză miocardică în circulația generală, rata de dispariție a sângelui său, fracția de enzimă miocardice inactiveaza la amplasarea și volumul în care este distribuit de necroza miocardica enzimă eliberată.
Creatin kinaza (CK) catalizează reacția de formare a creatinei:
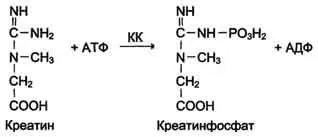
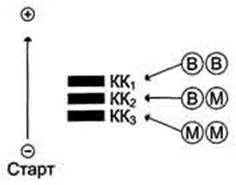
Molecule QC - dimer format din două tipuri de subunități: M (din engleză, mușchi - mușchi) și B (din engleză, creier - creier). Dintre aceste subunități formate izozimică 3 - BB, MB, MM. BB izoenzime se găsește în principal în creier, MM - în mușchii scheletici și MB - mușchiul cardiac. izoforme CK au o mobilitate electroforetică diferită (Fig.). molecula de creatina este alcătuită din două părți care pot fi reprezentate de una dintre cele două subunități: M, din mușchiul englezesc - „mușchi“, și B, creier - „creier“. Astfel, creatin kinazei in corpul uman este sub formă de trei izomeri: MM, MB, BB. MM izomer conținute în mușchii scheletici și miocardul, CF - în principal în miocard, BB - in tesuturile creierului intr-o cantitate mica in orice celule ale organismului.
In sănătoși creatina din sânge uman kinazei este prezentă în cantități mai mici, mai ales sub forma de MM izomer. Activitatea creatinkinaza este dependentă de vârstă, sex, rasă, masa musculară și activitatea fizică.
Rata activității QC nu trebuie să depășească 90 UI / L. Determinarea activității QC în plasma din sânge este de valoare diagnostică pentru infarctul miocardic (CF are loc creșterea izoforme). Numărul MM izoformei poate crește în leziuni și deteriorarea musculaturii scheletice. Izoenzimei BB nu pot penetra bariera hemato-encefalică, deci practic nici sânge este determinată și chiar și atunci când accident vascular cerebral are o valoare de diagnostic.