Foarte important, numere cuantice orbitale și magnetice
Legile statelor energetice ale atomilor atom de hidrogen și hidrogen, care rezultă din rezolvarea ecuației Schrodinger, aplicabilă altor atomi.
a) numărul .Kvantovoe n caracterizează energia totală a unui electron dintr-un atom, și de aceea se numește numărul cuantic principal. Numărul n de sovietici scade cu numărul cuantic principal în teoria lui Bohr. Electronii cu n obrazuyutobolochku.
b). Numărul l se numește numărul cuantic orbital. De la (13-6), că cea mai mare valoare Lmax pentru un anumit exista n-respectiv Lmax = n-1. Prin urmare, pentru un anumit număr cuantic orbital n poate lua următoarele valori:
Electron state având diferite ZNA-cheniyami numărul cuantic orbital l. in fizica atomica pot fi desemnate și denumite după cum urmează;
3 = 1 - f-stat, și așa mai departe, în ordinea literelor alfabetului ...
Electronii cu numărul l în obolochkeobrazuyutpodobolochku
B). Din soluțiile ecuației Schrödinger pentru funcția unghi care proiecția momentului unghiular în direcția selectată este de asemenea cuantizați, adică (- sm.13-5), adică Există spațiu cuantizare:
impuls vector unui electron poate avea numai o astfel de orientare în spațiu-stve la care proiecția Lz vectorul L în direcția z a câmpului extern primește valori multipli cuantificați.
Câmpul magnetic extern poate fi generat fie de o sursă externă, fie electronii înșiși atom.
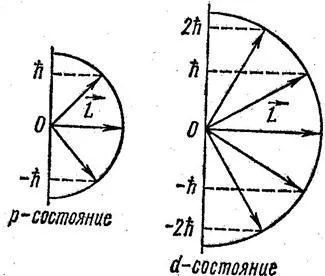
Numărul m este magnetic cuantic număr având depozite de valori: m = 0, ± 1, ± 2, ± 3. ± l; Aici l - numărul cuantic orbital specificând vectorul unitate L (4,13 cm.). Astfel, vectorul poate primi L 2l +1 orientare în spațiu. Fig. 13-2 ilustrează posibila orientare vectorii L, pentru electroni în stările P- și d- (l = 1 si l = 2).
Degenerării nivelurilor de energie.
Sa arătat mai sus că fiecare nivel cu numarul cuantic principal-fik n exista Corespunzător compenseze-n state cu diferite numere cuantice l = 0, 1, 2, (n-1). Această stare se numește degenerată.