Determinarea potențialelor de electrod de metale
fizica și tehnologia de comunicare optică
LABORATOR DE LUCRU №5
DETERMINAREA Potențialele de electrod METALELOR
Se determină potențialele electrod de Cu, Pb, Zn, Fe, Ni. Pentru a studia variația potențialului de electrod de zinc, în funcție de concentrația soluției de sare de zinc.
Orice metal are o solubilitate în electrolit, deși nesemnificativ. Dacă placa metalică scufundată, de exemplu, în apă, ionii metalici, ca urmare a ei molecule de apă polare pot desprinde de pe suprafața și du-te în stratul adiacent de apă; astfel încât, înainte de atom neutru este convertit într-un ion încărcat pozitiv:
Procesul este dinamic în natură, astfel încât în electrolit la suprafața metalică pentru a crea concentratii de redistribuire a ionilor de solvent și de metal și molecule de solvent.
Astfel, interacțiunea metalului cu apă sau o soluție care conține ioni de metal, rezultând formarea la suprafața stratului dublu electric, iar apariția unei diferențe de potențial între metalul și soluția. Această diferență de potențial include o scădere potențială în stratul ionilor adsorbiți de suprafață (JA) și potențiala picătură în soluție (în stratul de difuzie (Jd):
ionii metalelor tranziționale în soluție - un proces reversibil și izotermă, aici sistemul face maxim de lucru util A. caracterizat potențialul izobară-izotermă Gibbs DG ° p:
unde n - încărcătura de ioni; j - diferența de potențial dintre metal și soluția, F - numărul lui Faraday.
Equilibrium este dinamică: porțiunea strat de suprafață a ionilor difuze în electrolit, alți ioni din soluție le înlocuiește. Ca rezultat, concentrația de echilibru a ionilor metalici de la C0 suprafața electrodului este diferită de concentrația medie a ionilor în soluție C.
operație izotermice pentru ionii între 1 mol și cantitatea stratului de suprafață a soluției în mișcare este definită ca:
Din condiția ca aceste lucrări ar trebui să fie:
De aici poate fi găsit potențialul de electrod:
concentrația de C0 determinată experimental este posibil, astfel potențialul electrodului izolat cufundat în soluția de electrolit, nu este posibil să se calculeze. Cu toate acestea, se poate determina diferența de potențial (emf = DE = j2 - j1) între aceleași electrozi cufundați într-o soluție de ioni proprii, dar cu concentrații diferite, o celulă de concentrare așa-numita:
sau pentru condiții standard (298 K), și după înlocuirea logaritm natural la zecimal:
Metalului Electrochimie electrodului se măsoară în general potențiale în volți, desemnat E, în raport cu un electrod standard de referință, care potențial este convențional considerat ca fiind zero. Prin acord internațional, cum ar fi un electrod de referință, se utilizează un electrod standard de hidrogen. o cantitate noțional caracterizarea potențialului electrodului luat în considerare, sunt luați EMF celulei, compus din acest electrod și un electrod standard de hidrogen. Această cantitate se numește potențialul de electrod al electrodului și este notat cu litera E o. Astfel, luând concentrația ionilor metalici din stratul adsorbit C0 = 1 mol / l, obținem elementul EMF compus dintr-un singur tip de metal, ci, la concentrații diferite de ioni în soluție:
în care CMe n + - concentrația molară a ionilor.
Această ecuație se numește ecuația lui Nernst.
Ecuația este aproximativă, deoarece nu ia în considerare interacțiunea ion-ion în soluții de electrolit. Activitatea ion injectat asociat cu concentrația sa următoarea ecuație pentru a ține cont de această interacțiune:
unde f - coeficient de activitate.
Ecuația pentru calculul potențialului de electrod, de asemenea, are forma:
Ordinea de performanță
Activitatea desfășurată în două etape: prima etapă se măsoară Potențialele de electrod standard de metale când sunt introduse în soluții de săruri corespunzătoare cu concentrații de 1 mol / l; într-o a doua etapă dependența potențialului de electrod al metalului (zinc), prin imersare într-o sare de zinc soluții cu concentrații diferite: 0,1 M; 0,5M; 1,0M și 1,5M.
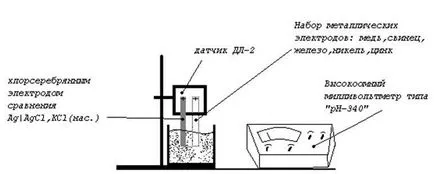
1. Ia un set de electrozi.
2. Înainte de măsurătorile de fiecare dată să benzi de electrod de suprafață șmirghel.
3. electrozi Succesiv investigați conectat la senzor, ceea ce face circuitul electrodului de măsurare galvanic și electrodul de referință clorură de argint. Ambii electrozi, astfel, trebuie să fie transportate într-o soluție de sare adecvată a concentrației dorite.
4. Instrumentul va determina FME.
5. Calculati valoarea tensiunii măsurate (DE) în mV. În acest scop, unitatea de citire obținute înmulțit cu 100.
6. După fiecare electrod de măsurare clorură de argint trebuie să fie imersată în apă distilată.
Efectuat experimente si de a face calculele necesare, am determinat potențialele electrozilor de cupru, plumb, fier și nichel, și de asemenea, a studiat variația capacității electrodului de zinc, în funcție de concentrația soluției de sare de zinc cu eroarea noastră a fost de la 15% la 24%, din cauza electrodului de curățare defect înainte de fiecare măsurătoare.
De asemenea, am găsit unele diferențe în teorie și practică:
Odată cu creșterea concentrației de zinc crescut potențial de electrod
articole asemanatoare
Informații despre activitatea
Rapoarte privind activitatea de laborator
Pentru a imprima fișierul, descărcați (în format Word).