bond 3 Chimice
Legătura chimică - este interacțiunea dintre doi atomi, realizat în redistribuirea electronilor din orbitalii de valență, în care există o configurație stabilă opt sau doi electroni a unui gaz nobil cel mai apropiat (octetul sau d) datorită formării de ioni (V.Kossel) sau formarea de perechi de electroni partajate (T .Lyuis). Energia totală a sistemului, în același timp redus.
3.1 Caracteristicile principale ale bonding chimice
3.1.1 Legare energie - energia necesară pentru a rupe legaturile chimice în toate moleculele care constituie un mol de câștig substanțe sau energie în timpul formării compusului atomilor individual (Eb). Cu cât energia legăturii chimice, cu atât mai puternic link-ul în sine, mai stabil molecula.
De obicei, energia de legare este măsurată în kJ per mol, kJ / mol.
kJ / mol. Pentru a polihidric compuși cu legături de același tip de energie de legare a primit valoarea medie calculată prin împărțirea energiei formării compusului atomilor pe numărul de legături. Astfel, în scindarea legăturii H-H cheltuit 432,1 kJ / mol ∙, și atomizarea CH4 metan - 1648 kJ / mol ∙, în acest caz, EC-H = 1648: 4 = 412 kJ.
Mai ales puternice legături ionice și covalente. energia care variază de la zeci la sute de kJ / mol. Liantul metalic este legături ionice și covalente, de obicei, ușor mai slabe, dar valoarea energiei de legătură din metalele sunt apropiate de valorile energiei legături ionice și covalente. energia legăturii de hidrogen este foarte mică și este, de obicei, valoarea 20-40 kJ / mol, în timp ce energia legăturile covalente pot ajunge la câteva sute kj per mol, kJ / mol.
3.1.2 Lungimea LSV comunicării. Dacă legarea chimică are loc doi nori de electroni suprapuse ale atomilor și distanța dintre nucleele atomilor devine mai mică decât suma distanțelor de nucleele zonele exterioare de cea mai mare densitate de electroni din atomi.
Lungimea legăturii egală cu distanța dintre nucleele interactioneaza atomii din compus. Se măsoară în nanometri, nm sau angstromi A (1 A = 10 -8 cm). Depinde de mărimea cojile de electroni, precum și gradul lor de suprapunere. Există o corelație certă între lungimea și energia de legare: o dată cu scăderea lungimii legăturii, de obicei, crește energia de legare a moleculelor și în consecință rezistența la dezintegrare sau expuse la alte substanțe.
3.1.3 Conexiune polaritate este caracterizată prin componenta ionic, adică deplasarea unei perechi de electroni unui atom mai electronegativ, formând astfel un dipol. Dipole - un sistem de două sarcini egale, dar opuse, care sunt la unitatea de distanță unul de celălalt. Polaritatea conexiunii poate fi exprimată prin momentul său de dipol μ. egală cu produsul de dipol sarcina electrica elementara, lungimea μ = e ∙ l. Momentul dipol este măsurat în coulombi pe metru, CI ∙ m, sau Debye, D.
1D ∙ = 0,333 10 -29 m ∙ Cl. Este o cantitate vectorială și este direcționat de-a lungul axei dipol de sarcină negativă la pozitivă.
Polaritatea moleculei ca întreg este determinată de diferența în electronegativities atomilor care formează geometria legăturii două centre a moleculei, precum și prezența perechilor de electroni nepuse, ca parte a densității de electroni din molecula nu poate fi localizată în direcția legăturilor. Este exprimat în termeni de momentul său dipol, care este egală cu suma vectorială a momentelor dipol ale legăturilor moleculei.
În cazul în care distinge momente de dipol (polaritate) și conectarea întregii molecule. De exemplu, pentru o moleculă de CO2 liniară μ = 0 (deși fiecare dintre polaritatea și molecula ca întreg non-polar, deoarece molecula este G = C = O este liniară, iar dipol momentele de C = O se anulează reciproc), dar H2O p ≠ 0. prezenţa momentului dipol într-o moleculă de sens a apei, care este non-liniară, adică. e. conectarea o-H, la un unghi nu este egal cu 180 °.
3.1.4 Structura spațială a moleculelor - este forma și aranjamentul în spațiu nori de electroni, luând în considerare natura legăturii chimice.
În compușii care conțin mai mult de doi atomi, o caracteristică importantă este unghiul de valență format prin legături chimice în moleculă și care reflectă geometria sa.
3.1.5 Procedura de comunicare (multiplicitate comunicare) - este numărul de perechi de socializat împărțit între doi atomi legați. Cu cât ordinea de conectare, atomii mai puternic interconectate și link-ul de mai scurt în sine. Ordinea linkurile de mai sus trei nu este găsit. De exemplu, ordinea de comunicare în molecule H2. O2 și N2 este egal cu 1, 2 și 3, respectiv, deoarece, în aceste cazuri, comunicarea este formată prin suprapunerea una, două sau trei perechi de nori de electroni.
3.1.6 comunicare saturație - capacitatea unui atom de a da un anumit număr de legături chimice. Unele tipuri de saturability interacțiune chimică nu au, adică, particulele se pot forma numere diferite de conexiuni cu vecinii săi. Această proprietate este inerentă legăturii ionice.
3.1.7 Metoda de suprapunere a norilor de electroni. Cu titlu de suprapunere a norilor de electroni sunt împărțite în σ comunicare - legătură și π - legătură (Figura 4).
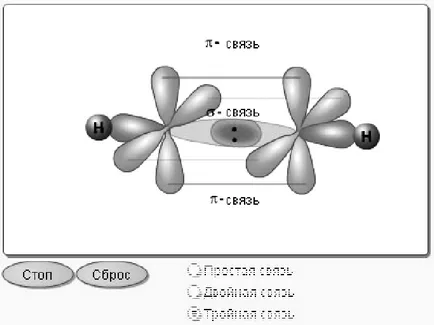
Figura 4 - Schema de σ - și π - conexiune
σ - legătură se formează datorită suprapunerii norilor de electroni ale liniei care leagă centrele inter-active ale atomilor. Acesta poate, de exemplu, între doi nori s-, P- între doi nori între nori și P- sau S- între nori și d- S-. π - legătură se formează datorită suprapunerii de nori de electroni pe fiecare parte a liniei care leagă centrele atomilor care interacționează (datorită suprapunerii laterale a norilor de electroni). Acesta este format într-o suprapunere substanțială orbitali p. σ - obligațiuni este mai puternică decât tt - obligațiuni deoarece oferă o suprapunere mai completă și, prin urmare, este nevoie de o pauză să-și petreacă mai multă energie.
Teoriile care explică legătura chimică
folosită în prezent două teorii: metoda de legături de valență (MBC), cât și metoda orbitali moleculare (OMI).
3.2.1 Metoda teoriei legătură de valență se numește, de asemenea, perechi de electroni localizate ca în metodă se bazează pe presupunerea că formarea atomilor moleculelor rețin orbitali atomice, ci la creșterea densității de electroni (perechea de electroni total), care aparține ambii atomi. Spre deosebire de OMI, care este pur și simplu o legătură chimică poate fi o dublă, și un multi-centru, în MBC este întotdeauna doi electroni în două centre și să fie sigur.
Rețineți că electronii în conformitate cu principiul lui Pauli ar fi invers direcționate înapoi, adică în MVS toate rotirile sunt împerecheate, și toate moleculele ar trebui să fie diamagnetic (deoarece proprietățile magnetice sunt cauzate de prezența electronilor liberi). În consecință, principiul MFR poate explica proprietățile magnetice ale moleculelor.
3.2.2 Metoda orbitali moleculare bazate pe faptul că fiecare orbital molecular reprezentat ca suma algebrică (combinație liniară) de orbitali atomici. Adică, formarea de molecule de orbitali atomici ca atare dispar, iar în locul lor există noi orbitali moleculare. Mai mult, numărul de orbitali moleculare este suma inițială atomic, dar o parte din orbitalii moleculare ale energiei inferioare (legare MO), și o parte din energia de mai sus (dezintegrare MO) decât inițial atomic.
De exemplu, în molecula de hidrogen în formarea MO pot participa numai orbitali atomici 1s a doi atomi de hidrogen, care dau două MO. Deoarece nucleele în care interacționează atomii de hidrogen sunt aceleași, atunci contribuția orbital atomic este aceeași. Si din moment ce molecula de hidrogen interacțiune este posibilă numai prin axa moleculară, fiecare OM poate fi redenumite sigma de comunicație și sigma * și numit, respectiv, legarea (σ legare) și antibonding (σ *) orbitali moleculare.
Două Electron de transfer al sistemului de comunicații MO σ facilitează reducerea energiei de; Acest câștig de energie este energia de legătură între atomii de hidrogen din molecula H-H. Adică, electronii care leagă soluționarea MO Sf. Σ stabilizează sistemul și decontarea dezintegra - destabilizeaza-l.
Conform ordinului metodei OM (multiplicitate) a unui svyazinopredelyaetsya semi svyazyvayuschihNsvi razryhlyayuschihNrazelektronov
Cu cât este mai multitudinea de comunicații, în special legătura puternică în moleculă. La zero, multiplicitate se formează molecula de conexiune.
Luați în considerare unele cazuri, structura moleculară a OMI.
molecula H2 format din doi atomi de H, dintre care valența atomică este prezentată de către un electron la 1S- subnivel. În ceea ce este necesar ca electronii au rotiri opuse. Aceasta reprezintă structura moleculelor H2 pe următoarea diagramă energetică (Figura 5). La completarea acestei diagrame în minte principiile de umplere a orbitalilor de electroni (principiul lui Pauli, principiul lui Hund, principiul energiei minime).
Figura 7 - Schema energetică a moleculelor He2
În acest caz, conexiunea va fi egală cu multiplicitatea n = (2-2) / 2 = 0, adică, comunicarea nu se realizează, deoarece nu există nici o pereche de electroni comună și nici un câștig în energie. O moleculă care nu este produsă în aceste condiții.
Pentru hidrogen si heliu sunt componente care au o structură mai complicată a învelișului de electroni, prin urmare, moleculele produse de aceste substanțe vor avea o structură corespunzătoare.
Luați în considerare acest exemplu în molecula O2 (Figura 8). Acesta este format din doi atomi de oxigen cu avz 2s 2 2p 4. Deoarece orbitalii au S- mai puțină energie decât p. pe diagrama de energie, acestea vor fi plasate mai jos. Vă rugăm să rețineți din nou că electronii de valență atomi diferiți au spini antiparalele. Deoarece fiecare atom oferă o orbită și orbitali s- trei p, numărul total de orbitali moleculare este egală cu opt. Dintre cei doi orbitali atomici formate două moleculare S-: σs - legarea și σs - dezintegrare (deoarece suprapunerea de nori de electroni are loc pe linia care leagă centrele atomilor).
Dintre cele șase p orbitalii formează trei lipire și trei orbitali antibonding. Datorită faptului că o pereche de nori de electroni se suprapun pe linia care leagă centrele atomilor, se formează între ele și conectarea σr- σr- antibonding orbitali moleculare. Între cele două perechi rămase ale p orbitali va fi o suprapunere laterală, astfel format două orbitali de unire r-, egale în putere și două dezintegreze r-, exact aceeași energie. In diagrama σr de energie - lipirea orbitala situată sub r- de legare, de la formarea conexiunii σ- se alocă mai multă putere, astfel link-ul în sine va avea mai puțină energie stocată. Umplere electroni diagrama (electroni 12 de la doi atomi) are loc odată cu creșterea energiei orbitale moleculare (în sus). Pe antibonding orbitale doi electroni sunt în locații diferite, la fel ca în acest caz, spinul totală a sistemului este maximizată. Multiplicitatea comunicării în acest caz, va fi egal cu n = (8-4) / 2 = 2, adică relație și cu două perechi de electroni.
