Anodică de dizolvare - enciclopedia chimică
Anodică de dizolvare a metalului. electrochimice. oxidarea metalului în p-D sau electrolit topit pentru a forma o grupare p - produse solubile și de retragere a electronilor eliberați într-un extern. lanț. In termeni generali, acest proces poate fi scris după cum urmează. mod:
unde M este un atom de metal. n-numărul de electroni eliberați. În conformitate cu legea lui Faraday. ., Etc. în absența dependenței țiilor p-electrod între viteza de oxidare a metalului V [g / (cm2 * s)] și o densitate de curent anodic i este de forma:
Anodic de dizolvare este baza dimensionale electrochimice. prelucrarea metalelor și aliajelor acestora și electrochimică, călire bloc anod metalic. material prin îndepărtarea unui Povet subțire deformat mecanic. straturi folosind p - anod solubil în timpul electrochimică. rafinarea metalelor și galvanizare. Prin dizolvare anodică în mijloc. luatats dependente de exp. caracteristici galvanice. celule și baterii. precum și comportarea la coroziune a structurii. bloc de metal. materiale.
Cele mai importante caracteristici ale i dependența anod-dizolvare pe relația parțială inversă derivat al electrodului potențial E și. numit. polarizabilitatea și fiind tehn. anozi de dizolvare caracteristice. Aceste dependențe pot fi de concentrare. sau cinetică. (Activare) natura. caz în care este pus în aplicare în practică depinde de relația dintre I și E pentru un anumit schimb io curent. și anume densitatea de curent la potențialul de echilibru atunci când este exact egală cu densitatea de curent a procesului invers - depunerea de metal catodic. pentru i
unde E - potențialul de electrod standard de. [M n +] - concentrația sub suprafață a ionilor metalici. T abs. temp, constantă R-gaz. Cu toate acestea, potențialul de echilibru rămas variază, deoarece [M n +] y crește Îmbrăcînd sti proporțional cu viteza de dizolvare anodică (adică, i densitatea de curent). Respectiv. dependența de E pe ur-i descrise Niemi:
unde K - empirice. coeficient. MB-ur set Este rupt atunci când este atinsă limita de sare p rimosti. format cu un metal de anioni de electrolit. și [M] încetează să crească. Dacă precipitatul rezultat este liber și nu împiedică în mod semnificativ trecerea curentului, continuarea metalul este practic non-polarizabil. Un astfel de exemplu. natura otritsat non-polarizabil. plăci de baterii de plumb.
Electroliți apoase p pax polarizabilitatea descrisă concentrare. tip caracteristic metalelor de tranziție din grupele I și II (Ag, Cu, Zn, Cd), la ochi caracteristică io valori mai mari. Cea mai importantă caracteristică sa - dependența de E nu numai pe i, dar, de asemenea, cu privire la intensitatea amestecării p-pa.
Când i> io continuă dizolvare cu cinetică. control, adică, Sa limitat electrochimica. pas - transferul particulelor încărcate prin metal rr, iar viteza variază în funcție de potențialul de E al legii:
undeva asa. numit. coeficienți. de transfer. Acest tip polarizabilitatea special caracteristic grupa metalelor de tranziție VIII (Fe, Ni, Co, etc.), la- caracterizate prin valori scăzute ale io.
Pe scena de limitare, și, prin urmare, întregul proces poate avea o mare influență etapa precedentă de adsorbție și chimice. interacțiune. atomi de metal de suprafață cu componentele r-ra (moleculele p-ERATOR, anioni electrolitice). Având în vedere acest stadiu și mecanismul ratei de dizolvare anodică poate fi exprimată după cum urmează:
în care A - este componenta adsorbit r-ra, și m este numărul de molecule sale. implicate în proces, K1 - constant. În funcție de condițiile de adsorbție poate stimula sau inhiba dizolvarea anodică (t m. B. pozitiv sau negativ). Respectiv. administrarea la rr sau scoaterea din ea a componentelor adsorbante - una dintre cele mai eficiente metode de reglare a vitezei de dizolvare a anodului în domeniu. Stimulentele sunt utilizate pe scară largă în tehnologii electrochimice dimensionale. metale. precum și pentru a reduce anozi solubili polarizabilitatea. Folosind un inhibitor de dizolvare a anodului - una dintre cele mai importante metode de protecție a metalelor împotriva coroziunii (vezi inhibitori de coroziune.).
Anodică de dizolvare. produsele finite la- sunt cationi polivalenți sau complecși ai acestora, curge în general printr-o serie de etape one electron (n - 1), fiecare dintre ele în funcție de condițiile pot fi limitative. În același timp INTERM. ioni metalici de starea de oxidare scăzută este adesea dookislyayutsya nu numai starea de echilibru (uneori mai puțin) electrochimic, dar, de asemenea, ca rezultat al interacțiunii directe. cu oxizi. componenta r-ra (molecule de oxigen dizolvat. ioni H +), de exemplu. de p-TION:
În aceste cazuri, rata totală de dizolvare anodică poate depăși semnificativ valoarea calculată de curent numai.
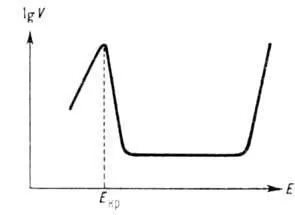
Adesea complicate de fenomenele de dizolvare anodică secundare. Astfel, formarea pe pansament-IFPS dizolvând faza metalică sau straturile de sare adsorbție sau pasivare oxid conduce la dizolvarea anodică (vezi. Metale Pasivitatea) la cer se manifestă în slăbirea vitezei sale în funcție de capacitatea de a realiza dizolvarea limitarea densității curentului. și, uneori, să se schimbe în funcție de tipul. În mediu apos a crescut. înclinației spre pasiveze diferă mult. metale tranziționale (Mo, Cr, Ni, Fe, etc.). Ele sunt caracterizate de critice. potențial Ecr. în funcție de natura metalului și pH-r-ra. La atingerea Ecr de obicei o creștere a ratei de dizolvare anodică se înlocuiește cu său ascuțit inferior, uneori până la câteva. ordine de mărime. Ulterior, într-o gamă largă de valori potențiale ale ratei de dizolvare anodică este menținută constantă, și apoi începe să crească exponențial cu potențial (vezi. Fig.). Acest din urmă fenomen este cunoscut ca superpassivation, datorită unui nou proces anodic (oxidare la ionii metalici de valențele mai mari) la-ing-l la baza electrochimice. Tehnologia producătoare de port mai mare de oxigen. un număr de metale. de ex. Mn, Cr. Atunci când aliajul de dizolvare anodică posibila tranziție inegală a componentelor sale în p-p, adică, dizolvarea selectivă a unor componente și îmbogățirea suprafața stratului de aliaj altele.
===
App. Literatura pentru articolul „dizolvare anodică.“ Kolotyrkin YM "Nature", 1979, numărul 11, pp. 2-13: propria sa, ".Zaschita Fier", 1983, 19 m, № 5, pp .. 675-85; Bazele teoriei și practicii prelucrării electrochimice a metalelor și aliajelor. M. 1981. JM Kolotyrkin.