substrat dehidrogenarea și oxidarea hidrogenului (formarea H2O), ca sursă de energie pentru sinteza ATP
Nume: substrat Dehidrogenarea și oxidarea hidrogenului (formarea H2O), ca sursă de energie pentru sinteza ATP. NAD și FAD dependente dehidrogenaza, ubiquinone dehidrogenaza, citocrom și citocromul
Specializarea: Biologie și Genetică
Descriere: Electronii cu potențial ridicat de energie transmis de la coenzime reduse NDH FDH2 și oxigen printr-un transportor cu lanț localizat în membrana internă a mitocondriilor. Ele catalizează tipul de reacție: RCHOHR1 ND↔ RCOR1 NDH H. Cu toate acestea, cu posibila includere a electronilor NDPH CPE prin acțiunea transhidrogenază piridină nucleotidice catalizează reacția: NDPH ND PND NDH. Prin FMNsoderzhaschim enzime aparțin NDHdegidrogenaza, care este, de asemenea, localizate în membrana internă a mitocondriilor; l.
Dimensiune fișier: 152.07 KB
Job descărcat: 14 persoane.
substrat dehidrogenarea și oxidarea hidrogenului (formarea de H 2 O), ca sursă de energie pentru sinteza ATP. DNA și dependente de FAD dehidrogenaza, ubiquinone dehidrogenaza, citocrom și citocromoxidază.
Energia eliberată în timpul metaboliților de oxidare enzimatice dehidrogenaze specifice. În reacțiile de dehidrogenare, electronii și protonii sunt transferate de la substraturi și coenzime organice NAD- dehidrogenaze dependente de FAD. Electronii cu potențial ridicat de energie, transmisă de la coenzimele reduse NADH și FADH2 oxigen prin intermediul transportorilor cu lanț localizate în membrana internă a mitocondriilor. Moleculele de recuperare O2 apare ca rezultat al transferului de electroni 4. Fiecare unește oxigen-2 electroni care ajung la acesta printr-un agent de transfer de lanț, sunt absorbite de matrice 2 protoni, formând astfel o moleculă de H2O.
Oxidarea materiei organice în celule este însoțită de consumul de oxigen si sinteza apei, numită respirația tisulară. și lanțul de transport de electroni (CPE) - lanțul respirator.
Electronii care intră în CPE, după cum se mișcă de la un operator de transport la cealaltă energie liberă pierde. O mare parte din această energie este stocată sub formă de ATP, și o parte din energia este disipată sub formă de căldură. Mai mult decât atât, electronii cu un potențial energetic ridicat, având ca rezultat oxidarea diferitelor substraturi pot fi utilizate în reacțiile de biosinteză pentru care adăugarea de ATP necesare reducerii echivalente, cum ar fi NADPH.
Transferul de electroni din substraturi oxidate la oxigen are loc în mai multe etape. In aceasta implică un număr mare de vectori intermediari, fiecare fiind capabil de a atașa electroni din componenta precedentă și pentru a transmite următorul. Deoarece există un lanț de reacții redox, care rezultă în procesul de recuperare au loc sinteza O2 și H2O. Lanțul respirator mitocondrial include un număr mare de transportatori.
Cu excepția ubiquinone (KoQ), toate componentele CPE - proteine. Ca parte a acestor proteine conțin diverse componente neproteice: FMN, Fe în compoziția proteinelor fier-sulf și care constau din inele porfirine ioni de Cu.
hidrogen primar acceptori. Primar acceptori de hidrogen reacție redox atribuit două tipuri de dehidrogenaze: nikotinamvdzavisimym. coenzime care conțin derivați de acid nicotinic și flavinzavisimym. derivați conținând riboflavin.
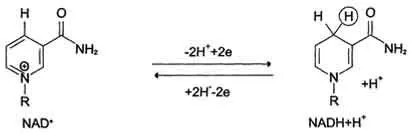
Nikotinamidzavisimye dehidrogenaza conțin ca coenzime NAD + sau NADP + (vezi. Secțiunea 2). NAD + și NADP + - derivați de vitamina PP. Aceste coenzime fac parte din centre active ale dehidrogenazele, dar poate fi disociată de complex reversibil cu apofermentami și incluse în enzimă în timpul reacției. Substraturi NAD- și NADP-dependente dehidrogenaze sunt localizate în matricea mitocondrială în citosol. o parte de lucru coenzimei nicotinamida este nicotinamida.
Majoritatea dehidrogenaze furnizeaza electroni CPEs contin NAD +. Ei cataliza tipul de reacție:
R - CHOH - R1 + NAD + ↔ R - CO - R 1 + NADH + H +.
Astfel, NAD +, atașarea protoni și electroni din diferite substraturi, servește ca principalele substanțe oxidabile colectoare de energie și principala sursă de electroni cu potențial ridicat de energie, pentru CPE. NADPH nu este un donator de electroni directă în CPE, și este utilizat aproape exclusiv în biosinteza de regenerare. Cu toate acestea, cu posibila includere a electronilor în NADPH CPE prin acțiunea transhidrogenază piridină nucleotidice, catalizează reacția:
NADPH + NAD + ↔ NADP + + NADH.
Flavin dehidrogenaza conțin ca coenzime FAD sau FMN. Aceste coenzime sunt formate în corpul de vitamina B2. coenzime Flavin puternic asociat cu apofermentami. Lucrul parte a FAD si FMN este izoalloksazinovaya sistem de inel conjugat.
FAD este acceptor de electroni la multe substraturi în reacțiile de tipul:
R-CH2-CH2-R1 + E (FAD) ↔ R-CH = CH-R1 + E (FADH2),
unde E - o parte de proteine a enzimei.
Cele mai multe dintre dehidrogenazele dependente de FAD - proteine solubile localizate în matricea mitocondrială. O excepție este dehidrogenaza succinat, localizat în membrana mitocondrială internă. Pentru FMN care conțin enzime aparțin dehidrogenaza NADH, care este localizată în membrana internă a mitocondriilor; oxidează NADH, care se formează în matricea mitocondrială.
electroni lanț de transport de la NADH și FADH2 electronilor de transfer de oxigen de la NADH la O 2 cuprinde un număr de purtători care sunt localizate în membrana internă a mitocondriilor. Cu excepția ubiquinone și citocrom C, acest complexe de proteine complexe.
Dehidrogenaza NADH (complex NADH-Q-reductaza I) constă din mai multe lanțuri polipeptidice. Rolul grupului protetice joacă FMN. Singurul substrat enzimatic - NADH, 2 din care transferul de protoni și electroni pentru a forma la FMN FMNH2. Al doilea proton este absorbit din matrice. Reacția are loc conform ecuației:
NADH + H + + e (FMN) → NAD + + E (FMNH2)
Cu electroni FMNH2 apoi transferate într-un număr de proteine de fier-sulf (FeS), jucând rolul de a doua grupă prostetică din NADH dehidrogenază molecula. Atomii de fier din aceste proteine (non-hem fier) sunt asamblate în mai multe grupuri, așa-numitele centre de fier-sulf. FES centre fac parte din mai multe proteine (flavoproteinelor citocromii) implicate în reacții redox. Există 3 tipuri de FES centre (FeS, Fe2S2, Fe4S4), în care atomul de fier este legat la un atom de sulf dintr-un rest de cisteină sau sulf anorganic. NADH dehidrogenaza Fe2S2 conține mai multe tipuri de centre și atomii de fier Fe4S4 în astfel de centre pot accepta și dona electroni, la rândul lor, trecând în ferro- (Fe2 +) și ferri- (Fe3 +) stare. Din fier-sulf centre electroni sunt transferate Q coenzima (ubiquinone).
Desemnarea acestei solubile în grăsime CHINON- derivate din primele litere ale numelor în limba engleză a chinonă (chinonă), iar numele ubichinonă reflecta larg răspândite în natură (omniprezent - omniprezent). molecula ubichinonă în funcție de sursa din care sunt alocate, diferă în lungime a lanțului, care la mamifere conține 10 unități izoprenoidici și este denumit Q10. Procesul transferului de electroni de la NADH-dehidrogenază la ubiquinone prin FeS convertit reversibil hidrochinona. Ubichinonă realizează funcția colectorului atașarea electroni din NADH-dehidrogenază și alte dehidrogenaze flavinzavisimyh în special de succinat dehidrogenaza. Ubichinonă este implicată în reacțiile de tipul:
E (FMNH2) + Q → E (FMN) + QH2.
Citocromilor sau hemoproteins prezente în toate tipurile de organisme. În celulele eucariote, acestea sunt localizate în membranele mitocondriale si in ER. Există aproximativ 30 de citocromilor diferite. Toate citocromilor ca o grupare prostetică care conține hem. Diversitatea lor se datorează:
- diferență în structura subiectului lanțurilor laterale;
- diferență în structura lanțurilor polipeptidice;
- diferență în metoda de comunicare cu lanțuri polipeptidice hem.
În funcție de capacitatea de a absorbi lumina la anumite lungimi de undă ale luminii tuturor citocromii sunt împărțite în grupuri a, b, c. În cadrul fiecărui grup, specii individuale cu proprietăți spectrale unice reprezintă numere de index (b, b1, b2, etc.).
Caracteristici structurale ale diferitelor tipuri de citocromele determina diferența lor în potențialul redox. Citocromii CPE 5 Tipul implicate (a, a3, b, c, c1). Cu excepția citocromului c, citocrom toate localizate în membrana internă a mitocondriilor sub forma de complexe de proteine complexe.
QN2 dehidrogenaza (coenzima Q-citocrom c D uktaza complex III) este compus din 2 tipuri de citocromii (b1 și b2) și c1 citocrom. QN2 transferă electroni dehidrogenaza din ubichinol citocromului c. In interiorul complexului electronii III sunt transferate de la citocromul b pe FES centre, c1 citocromul, urmat de citocrom c. Grup subiect, cum ar fi Fès-centre, transporta doar un singur electron. Astfel, din molecula QH2 2 electroni sunt transferate 2 molecule ale citocromului b. Ca un produs intermediar în aceste reacții de transport de electroni pot forma radicali liberi se-mihinona. In citocromul tip b hem nu este legat covalent la proteina, și citocromii c1 și este atașat la proteină prin intermediul obligațiuni tioesteri. Aceste legături sunt formate prin unirea a doua resturi de cisteină la grupările vinii hemului.
Citocrom C - proteină de membrană periferică solubilă în apă, cu o greutate moleculară de 12 500 D având un singur lanț polipeptidic de 100 de resturi de aminoacizi, și molecula de hem atașată covalent la polipeptidă.
citocromoxidază (IV complex) este compus din 2 tipuri de citocromii Aa3 fiecare dintre care are un situs de legare cu oxigen. Citocromilor a și a3 au o caracteristică zhelezoporfirinovuyu grupare prostetică numit-hem A și care diferă de citocromii hem c și c1. Acesta conține o grupare formil în loc de o grupare metil și o catenă de hidrocarbură în locul unuia dintre grupurile de vinil. O altă caracteristică a complexului a-a3 - prezența în ea a ionilor de cupru legați la proteină în așa-numitele astyu cua-centre. Transferul de electroni și a3-complex cuprinde reacția:
Cu + ↔ Cu2 + + e, Fe2 + ↔ Fe3 + + e.
Citocromul complex un-a3 reacționează direct cu oxigenul molecular.
