Studiul conductivitatea electrică a fluidelor și determinarea echivalentului electrochimică a cuprului
Scopul și obiectivul: Pentru a studia mecanismul trecerii curentului în electrolit și legile electrolizei, Electrolizei și elektrohimicheskogo definiție de cupru echivalent.
Substanțe soluții apoase care conduc electricitatea sunt denumite electroliti. Spre deosebire de metale, având conductivitate electrică și un semiconductor având un electron-gol electroliți conductivitate au o conductivitate ionică.
Uneori numit electroliți și soluții conductive în sine, deși o expresie mai corectă - o soluție de electrolit.
Moleculele de apă se descompun într-o mică măsură pe ionii:
Concentrația ionilor de hidrogen determină aciditatea soluției, iar concentrația ionilor hidroxil caracterizează alcalinitatea soluției. În apă pură, concentrația de ioni H + și OH - sunt egale. Apa pura disociază foarte slab. Într-un mol de apă la 22º C dezintegrează numai în ioni mol.
Cu toate acestea, pentru a obține o astfel de apă este foarte dificilă, deoarece aerul este mereu prezent în dioxid de carbon, care dizolvă apa crește concentrația de ioni de hidrogen. Deoarece apa are o constantă mare () dielectric și moleculele de apă au un moment de dipol semnificativ (Cl # 8729; m), în jurul moleculele de apă pe distantele interatomice (nm) există un câmp electric destul de puternic. Aceasta din urmă este o cauză directă a, atenuând forța de atracție electrostatică a ionilor în moleculele solutului. Prin urmare, în procesul de dizolvare a sării sau ciocnirile alcaline datorită descompunerii termice a moleculelor are loc la anioni și cationi. În cazul în care moleculele solutului în apă nu se disociază în ioni, soluția nu este un conductor. De exemplu, soluții apoase de zaharuri, glicerină - izolatori.
Rezultatul este formarea solvați de disociere (hidrați), în care moleculele de apă ionii „învăluie“, pentru a forma în jurul lor shell solvatare (Figura 1).
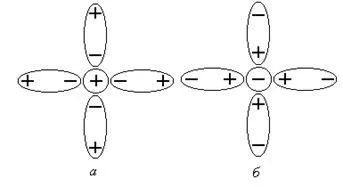
Figura 1 solvatare o coajă - cation; b - anion
Pentru producerea curentului electric în electrolit, trebuie să fie în baia cu soluția de electrolit la electrozi mai mici de material conductor (metal, carbon și altele asemenea) la care se conectează o sursă de curent (a se vedea figura 2). Un astfel de dispozitiv este numit baie galvanică sau electrolit.
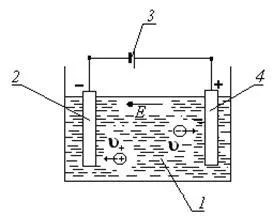
Figura 2 baie electrolitică 1 - soluție de baie
sulfat de cupru; 2 - un catod; 3 - o sursă de curent; 4 - un anod;
și - viteza de ioni pozitivi și negativi
In ionul din electrolit sunt două forțe: forța de forța câmpului electric și mișcarea de rezistența mediului. Forța exercitată de către câmpul electric calculat prin formula:
în care - taxa de ioni, CI; - intensitatea câmpului electric.
Forța. datorită interacțiunii dintre moleculele care înconjoară ionul este proporțională cu viteza:
în care - coeficient aerodinamic de ioni în mediu.
Când mișcarea de ioni din electrolit între forțele de echilibru se stabilește rapid și deplasarea ionilor între electrozii pot fi considerate uniform și rectiliniu, astfel:
Dacă vom desemna. atunci. Coeficientul b se numește mobilitatea ionilor. Sensul fizic al mobilității, care caracterizează viteza ionilor într-un electrolit în intensitatea câmpului electric E = 1.
Deoarece curentul din electrolit este o mișcare ordonată a ionilor ambelor semne, datorită acțiunii unui câmp electric extern, densitatea curentului din electrolit este determinat de expresia:
unde n + și - - concentrația de cationi și anioni; + Și - - - viteza lor de drift și + - - taxele lor.
Desfășurată la catod și anod reacția de oxidare-ing restauratoare sunt supuse Legii lui Faraday.
Prima lege. masa a evoluat la electrodul este proporțională cu substanțele care curg prin electrolit la taxa:
unde - echivalent electrochimice; I - curent, A; T - timp cu.
echivalente electrochimici ale unor elemente prezentate în tabelul 1.
Tabelul 1 Valorile echivalente electrochimice
pentru anumite substanțe
A doua lege. elemente echivalente electrochimice sunt direct proporționale cu echivalentele lor chimice:
unde F - numărul lui Faraday (F = 96500); M - masa molară a evoluat pe materialul electrodului; n - valență - echivalentul chimic.
electrooxidation sau electroreduction Produse electroliți pot intra în reacție chimică cu aproape soluția electrodului. Astfel de procese sunt numite reacții secundare.
Toate aceste procese sunt utilizate în diverse domenii ale tehnologiei, multe dintre ele sunt, de asemenea, utilizate în medicină.