Structura moleculelor de apă - Hidrogeologie
Apa - una dintre substanțele cele mai remarcabile cunoscute de om. Ea - singura substanță naturală găsită în cantități mari în trei stări: solidă, lichidă și gazoasă. Dintre toate comune apa lichid - cel mai versatil solvent lichid, cu valori maxime ale tensiunii superficiale, constanta dielectrică, și căldură mare de vaporizare (după amoniac) o căldură de topire. Spre deosebire de multe substante, apa, congelare la o presiune scăzută, se extinde.
Aceste proprietăți specifice de apă sunt legate de structura specială a moleculelor sale. Formula chimică H2 0 apă deceptively simplu. Atomii de hidrogen molecula de apă ale nucleului sunt aranjate asimetric în raport cu nucleul unui atom de oxigen și electroni. Dacă atomul de oxigen este în centrul unui tetraedru, centrele de masă ale doi atomi de hidrogen sunt la colțurile unui tetraedru și încărcăturile centrele a două perechi de electroni ocupa două alte colț (fig. 3.1). Astfel, patru electroni sunt aranjate pe cea mai mare distanță posibilă atât atomul de oxigen al nucleului, și nucleele atomilor de hidrogen la care sunt desenate atom de bază de oxigen. Alte molecule de apă șase electroni sunt aranjate astfel patru electroni sunt în poziția de a furniza o legătură chimică între nucleele atomilor de oxigen și hidrogen, iar celelalte două sunt situate în apropierea nucleul atomului de oxigen.
Dispunerea asimetrică a atomilor moleculei de apă determină o distribuție neuniformă a sarcinilor electrice în acesta, ceea ce face molecula de apă polară. O astfel de structură a moleculei de apă determină atracția moleculelor de apa unul cu altul, ca urmare a formării de legături de hidrogen între ele. Locație hidrogen si oxigen atomi în moleculele de apă formate agregate este similar cu aranjamentul atomilor de siliciu și oxigen din cuarț. Acest lucru este valabil și pentru gheață și cel puțin o moleculă de apă lichidă de agregate, care sunt întotdeauna în etapa de redistribuire. După răcire, moleculele de apă sunt grupate în agregatele care sunt crescute treptat și devin mai rezistente, deoarece se apropie temperatura de 4 ° C, când apa atinge densitatea maximă. La această temperatură, apa are încă o structură rigidă, și împreună cu moleculele sale cu catenă lungă, există un număr mare de molecule de apă individuale. Cu alte răcire lanțuri de molecule de apă crește prin adăugarea la aceasta de molecule libere, în care densitatea apei scade. Când apa este transformata in gheata, toate moleculele sale sunt mai mult sau mai puțin rigide structură sub formă de lanțuri neinchise care formează cristale.
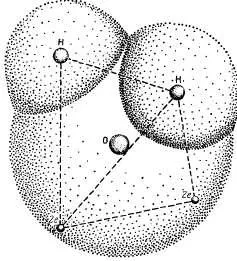
Fig. 3.1. Structura moleculei de apă.
Pătrunderea reciprocă a atomilor de hidrogen și oxigen. Nucleele de doi atomi de hidrogen și două perechi de electroni sunt la colțurile unui tetraedru: in centrul atomului de oxigen de bază.
Valori ridicate ale tensiunii superficiale și a căldurii de vaporizare a apei, datorită faptului că moleculele de apă sunt separate de grupul de molecule necesită un consum relativ mare de energie. Dorința de molecule de apă pentru a stabili legături de hidrogen și polaritate explica solubilitatea neobișnuit de mare de apă. Unii compuși, cum ar fi zaharuri și alcooli, sunt păstrate în soluție, datorită legăturilor de hidrogen. Compușii având un grad ridicat de ionizare de intrare, cum ar fi clorura de sodiu, sunt păstrate în soluție, datorită faptului că ionii sunt neutralizate de grupări încărcate oppositely de molecule de apă orientate.
abundență relativă și de înjumătățire a izotopilor de hidrogen și oxigen