Rolul moleculelor rapide
La orice temperatură, există o serie de molecule care viteza și energia cinetică prin urmare, considerabil mai mare decât media.
Este cunoscut faptul că multe reacții chimice, cum ar fi arderea combustibililor convenționali (lemn, cărbune, și așa mai departe. D.) Pornind doar la o anumită temperatură, suficient de ridicată. Energia necesară pentru a începe procesul de oxidare a combustibilului, adică. E. Combustion (numită energia de activare), este de ordinul 10 -19 J .. Și la 293 K (temperatura camerei), energia cinetică medie a mișcării termice a moleculelor este de aproximativ 5 x 10 -21 J. Prin urmare, nu se produce arderea. Cu toate acestea, creșterea temperaturii doar de 2 ori (până la 586 K) cauzeaza inflamatie. Energia medie a moleculelor crește în același timp, de asemenea, un factor de 2, dar numărul de molecule, energia cinetică a care depășește 10 -19 J, crește 10 8 ori. Acest lucru rezultă din distribuția Maxwell. Prin urmare, la o temperatură de 293 K, te simți, citind o carte, confortabil, și la 586 de carte K începe de ardere.
evaporarea lichidului este determinată și de moleculele rapide dreapta „coada“ a distribuției maxwelliana. Energia de legare a moleculelor de apă la temperatura camerei, in mod semnificativ mai Kt. Cu toate acestea, evaporare se datorează unui număr mic de molecule rapide a căror energie cinetică depășește kT.
Maxwell a descoperit un nou tip de lege fizică - o statistică și a găsit distribuția vitezelor moleculare. El a înțeles în mod clar importanța descoperirii sale. Raportul Societății Maxwell Cambridge Philosophical a spus: „Eu cred că cel mai important pentru dezvoltarea metodelor noastre de gândire au teoriei moleculare, deoarece acestea sunt forțați să facă o distincție între cele două metode de cunoaștere, pe care o putem numi o dinamică și statistică.“
§ 4.7. Măsurarea vitezei moleculelor de gaz
Ecuația fundamentală a teoriei cinetice moleculare a gazelor (4.4.9) a fost elaborat pe baza modelului gazului ideal. În acest caz, mai multe ipoteze de simplificare, a fost făcută imaginea reală. Pentru a verifica acceptabilitatea ipotezelor făcute, trebuie să verificați experimental derivată din ecuația (4.4.9) a anchetei. Una dintre principalele consecințe ale ecuației fundamentale teoria cinetică moleculară este dependența de viteza medie pătrată a mișcării termice a moleculelor (gaz caracteristici microscopice) a temperaturii (caracteristicile macroscopice ale stării de gaz). Această dependență și poate fi verificată experimental.
Viteza medie a mișcării termice a moleculelor
Din compararea (4.4.9) cu o ecuație termodinamic stare de gaz ideal a fost obținut prin expresia (4.5.5) pentru energia cinetică medie a mișcării de translație a moleculelor:
Prin urmare, medie viteza pătrat de mișcare de translație este:
Rădăcina pătrată din această cantitate se numește viteza medie pătratică:
Valoarea medie a vitezei pătrat este puțin diferită de viteza cea mai probabilă dată de expresia (4.6.9). Deoarece Boltzmann constantă egală cu constanta universală a gazelor raportul constanta lui Avogadro
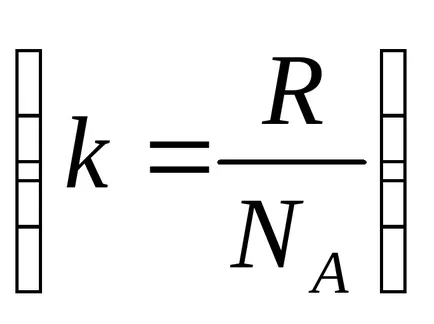
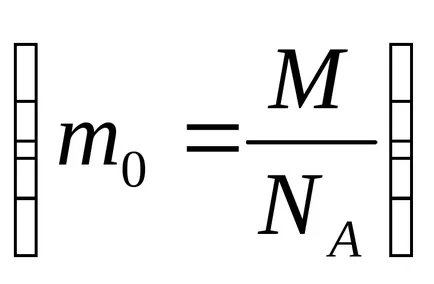
Calculat prin această viteză formulă

După cum se vede din tabelul, viteza de molecule sunt foarte mari - de ordinul a cojilor vitezei de artilerie - și oarecum mai mare decât viteza sunetului în gazul respectiv. La început, un astfel de rezultat a provocat confuzie în rândul fizicienilor. La urma urmei, dacă viteza moleculelor sunt atât de mari, cum se explica, de exemplu, mirosul de parfum, vărsat în camera, răspândind destul de lent; Ar trebui să dureze câteva secunde să miros răspândit în întreaga cameră. Dar pentru a explica acest fapt a fost destul de simplu. moleculele de gaz, în ciuda dimensiunii lor mici, se ciocnesc continuu unul cu celălalt. Din cauza numărului mare de molecule vitezei de coliziune a moleculelor de aer în 1 secundă în condiții atmosferice normale de până la câteva miliarde.
Calea medie liberă de molecule este egal cu 10 -4 -10 -5 cm. Prin urmare, traiectoria fiecărei molecule este polilinie foarte complexă (Fig. 4.14). moleculă mare are viteza pe porțiuni drepte înclinate. Mutarea aceeași moleculă într-o anumită direcție este mică chiar și în mijlocul timp de câteva secunde. Atunci când se deplasează moleculele de la punctul A la punctul B, calea parcursă de acesta este mult mai mare decât distanța AB.

Pentru a continua descărcarea aveți nevoie pentru a asambla o imagine: