Rezistența microorganismelor cauzate de beta-lactamaze, și modalități de a le depăși,
rezistență microbiană cauzate de beta-lactamaze, și despre modalitățile de depășire
În prezent, antibioticele beta-lactamice sunt cele mai frecvent utilizate medicamente pentru tratamentul infecțiilor bacteriene, dar eficacitatea lor poate fi redusă din cauza aspectului de stabilitate a acestora, cel mai comun mecanism de dezvoltare a, care este producerea de beta-lactamaze. Pentru a depăși acest mecanism de rezistență au fost sintetizați inhibitori specifici ai beta-lactamază, care poate inhiba activitatea unei game largi de beta-laktmaz produs de Gram patogeni Gram-pozitivi și negativi anaerobi. Acest articol va discuta despre mecanismul de acțiune și spectrul de activitate a unuia dintre cele mai frecvent utilizate beta-lactamice ingibitorozaschischennyh - amoxicilină / clavulanat.
Familia de antibiotice beta-lactamice includ patru grupe principale de antimicrobiene: peniciline, cefalosporine, carbapeneme și monobactami.
antibiotice beta-lactamice actioneaza asupra celulei bacteriene în două moduri de bază. În primul rând, ele sunt încorporate în peretele celular bacterian și inhibă activitatea transpeptidazei a enzimei implicate în etapa finală de construcție a pereților de bacterii. In al doilea rand, ei se leaga de proteine de legare a penicilinei (PBP), care inhibă în mod normal, celulele bacteriene hidrolază și eliberează astfel, hidrolază care duce la liza peretelui bacterian. Pentru a combate aceste mecanisme de bază ale acțiunii beta-lactamice bacteria dobândită capacitatea de a produce enzime speciale beta-lactamaze care pot hidroliza inelul beta-lactamic și a schimba tipul de structura PSB [1].
Sinteza beta-lactamază codificat de sau cromozomi (tip constitutiv), cum ar fi Pseudomonas aeruginosa, sau plasmide (tip inductibile), cum ar fi Aeromonas hydrophila și Staphylococcus aureus. Plasmidele pot fi transferate de la o bacterie la alta, contribuind la răspândirea rapidă a rezistenței.
Mecanismul de acțiune al beta-lactamaze
enzime de beta-lactamază distruge inelul beta-lactamic a două mecanisme majore. Primul mecanism lactamazelor inerente de clasa A, C și D (împărțirea în clase se realizează în conformitate cu secvența de aminoacizi din structura enzimei), este legat la substrat datorită prezenței unui situs activ flexibil special (Fig. 1). O legătură ireversibilă grupei carbonil cu inelul beta-lactamic carbon și perturbarea integrității sale, ceea ce face ca starea inactivă antibiotic și în același timp asigură regenerarea de beta-lactamază. Aceste clase de beta-lactamaze activ împotriva multor peniciline, cefalosporine și monobactami. Al doilea mecanism este inerent într-un grup mai puțin frecvente de beta-lactamaze, care aparțin clasei B. Enzimele din această clasă sunt numite metalo-beta-lactamaze, deoarece ele conțin deplasabil ion metalic bivalent este cel mai adesea ion de zinc, care este capabil de legare la gruparea carbonil a majorității peniciline, cefalosporine carbapeneme, dar nu monobactame [1].
Clasificarea beta-lactamază
Începând cu secolul XX '60 a propus mai multe clasificări ale beta-lactamază, în funcție de caracteristicile și diferențele în structura moleculară (tab. 1) [3-5] biochimice și funcționale.
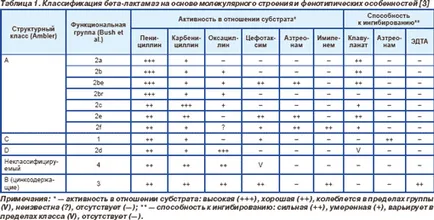
Cele mai importante clinic beta-lactamaze fac parte din clasele A și C. în particular, clasa A include cromozomiala beta-lactamază Klebsiella spp., Citrobacter diversus. Proteus vulgaris și cel mai Bacteroides spp. precum și aproape toate plasmida beta-lactamază. Clasa C cuprinde Amps cromozomiale cephalosporinase, clasa B - enzime OXA care sunt larg răspândite în plasmide enterobacterii. Clasa B cuprinde, după cum am menționat mai devreme, unele beta-lactamază având ion de zinc [3].
Cromozomale beta-lactamaze prezente în bacterii inițial, înaintea dezvoltării antibioticelor (AB): ele sunt implicate în metabolismul celulelor microbiene, precum și protejează bacteriile din beta-lactamazei produse de fungi în medii naturale. Cu toate acestea, în prezent, principalul factor de selecție tulpini - producători de beta-lactamază este de a utiliza beta-lactamic AB care promovează selecția artificială bacteriene în următoarele domenii: 1) producerea de cantități mai mari de beta-lactamază; 2) disponibilitatea suplimentară beta-lactamază codificate de plasmide; 3) mutația beta-lactamază existente cu extinderea spectrului lor de activitate. O astfel de artificială selecție selecție favorizat de specii întregi individuale sau tulpini de bacterii - producători de beta-lactamază, în care procesul de selecție, cu generarea de noi beta-lactamaze au avut loc în paralel cu dezvoltarea de noi medicamente antibacteriene, al căror scop a fost prezența stabilității la beta-lactamaze. Depășirea acestui mecanism de rezistenta a bacteriilor a fost realizată în două moduri: modificare chimică a combinației de antibiotice și beta-lactamice cu inhibitori de beta-lactamază.
Prima excitatoare a dobândit capacitatea de a produce beta-lactamază, oțel Staphylococcus: dacă în 1944 benzilpenicilină a fost activ față de 95% din tulpinile de Staphylococcus aureus. doar 5% din izolatele usate beta-lactamazei și au fost rezistente la ea, apoi după 5 ani, proporția de tulpini de beta-lactamază a crescut la 50%, iar după ani - până la 90%, din cauza transferului de gene și de selecție a unor tulpini rezistente. Crearea de 60-e ai secolului XX, meticilina și oxacilina rezistente la stafilococice beta-lactamaze și încă își păstrează eficacitatea clinică împotriva tulpinilor meticilină, este un exemplu de abordare care vizează modificarea chimică a AB [6].
Ulterior, probleme de rezistență AB cauzate de producerea de beta-lactamază afectate într-o mai mare măsură bacili gram-negative, care se datorează în mare măsură la dezvoltarea de noi AB (tabelul. 2) [3]. Unele bacterii Gram-negative au o rezistență naturală la producția de beta-lactamice din cauza unui număr mare de cromozomiale beta-lactamaze: Klebsiella spp. aminopeniciline rezistent (ampicilina, amoxicilina) și karboksipenitsillinam (carbenicilina si ticarcilina). Cu toate acestea, odată cu introducerea AB beta-lactamic activa impotriva florei gram negative valoare clinică microorganisme obținute au dobândit rezistență datorită sintezei de inductibile beta-lactamaze de clasa A (P.vulgaris, C.diversus) și inductibile beta-lactamază AmpC (Enterobacter spp . Citrobacter freundii. Morganella morganii. Providencia spp. Serratia spp. Pseudomonas aeruginosa), care a oferit-le rezistente la aminopeniciline și cefalosporine i generație. Cel mai important punct de vedere clinic consecință a utilizării beta-lactam activă împotriva florei gram-negative, a fost răspândirea plasmid beta-lactamaza TEM-1 predominant între specii inițial sensibile la acest AB. In prezent, 60% din tulpini de enterobacterii produc acest tip de beta-lactamază, a cărui frecvență depășește frecvența tuturor celorlalte tipuri (2-TEM, SHV-1, OXA-1) este mai mult de 10 de ori. Deoarece beta-lactamaza TEM-1 răspândirea la mijlocul anilor '70 la alte Bacilii gram-negativi, Pseudomonas și Vibrio cholerae. Acest tip de enzimă este unic reprezentant al plasmidului beta-lactamază de Neisseria gonorrhoeae, apar la 1-40% din tulpini. Aceeași enzimă produsă 2-40% tulpini de Haemophilus influenzae, în funcție de regiune și de capsulare geografică tipul și frecvența sa depășește un alt tip de beta-lactamază a microorganismului (ROB-1) de 10 ori. Și numai Pseudomonas și Moraxella catarrhalis TEM-1 pierde primatul, dând cale de a lui PSE-1 și PSE-4 de la Pseudomonas și BRO-1, 2-BRO la M.satarrhalis. In prezent, peste 80% din tulpinile M.satarrhalis produc beta-lactamază. Toate aceste beta-lactamazei (TEM-1-TEM 2, SHV-1, PSE-1, PSE-4, BRO-1-BRO 2) aparțin clasei A, oferind un nivel similar de rezistență la un amino, carboxi, ureido și piperazinpenitsillinam și generația cefalosporine i [7].
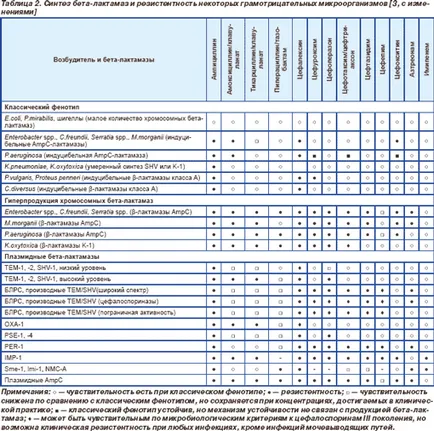
După crearea unei noi generații a apărut în Enterobacte R spp cefalosporinelor rezistenta la ele. C.freundii. Serratia spp. M.morganii. P.aeruginosa datorită sintezei crescute (supraproducția) de beta-lactamază AmpC, în care frecvența acestor tulpini în unele țări europene, până la 70%. Mai târziu, această enzimă a fost detectată în E.coli și Klebsiella spp.
La mijlocul anilor '80 XX spectru secolului beta-lactamază răspândire au fost identificate (ESBL), dintre care cele mai multe au apărut din cauza enzimei TEM-1 mutatii tip, TEM-2, SHV-1. Cel mai adesea, aceste beta-lactamaze se găsesc în Klebsiella spp. [8].
Carbapeneme au cea mai mare dintre toate rezistente la toate plasmid beta-lactamază din clasele A, C și D. beta-lactamic Cu toate acestea, în prezent există o generație de noi beta-lactamaze, în principal, de clasă, capacitatea de a inactiva carbapeneme. Printre acestea sunt cele mai importante enzime produse de maltophilia Stenotrophomonas. carbapeneme și utilizarea pe scară largă poate contribui la selecția ulterioară a acestei tulpini. De asemenea, temeri provoacă apariția de enterobacterii. P.aeruginisa, Serratia marcescens, K.rneumoniae plasmidic enzimă din clasa B (IMP-1), care asigură o rezistență la toate antibioticele beta-lactamice cu excepția monobactame [9].
Cea mai eficientă strategie care vizează depășirea unor mecanisme specifice de rezistență ca urmare a producției de beta-lactamază, pentru moment este de a utiliza ingibitorozaschischennyh beta-lactamice. spectru larg de activitate, datorită capacității de a inactiva o gamă largă de inhibitori ai beta-lactamazelor produse de gram-pozitive, gram negative cât și organisme anaerobe.
Și, deși acestea nu sunt un instrument de încredere pentru beta-lactamază cefalosporine cu spectru extins în locul de utilizare a acestora reduce selecția producătorilor de acest tip de beta-lactamază.
inhibitori de beta-lactamază sunt structura beta-lactamice, care se leagă ireversibil la enzimele ei insisi in timp ce a fi distruse, de aceea ele sunt numite inhibitori de sinucidere. În prezent, semnificație clinică au trei astfel de inhibitori: acid clavulanic (acidul clavulanic) și doi derivați ai acidului penicilanic - sulbactam și tazobactam.
Toți inhibitorii de beta-lactamaze inactiva majoritatea beta-lactamazelor de clasa A, în special enzime cromozomiale Bacteroides spp. C.diversus, Klebsiella spp. P.vulgaris. penicilinază stafilococice și TEM și SHV beta-lactamaze. - clasic și cu spectru larg (tabelul 3) [3]. Cu toate acestea, activitatea clavulanat și tazobactam împotriva enzimelor TEM este de aproape 10 ori mai mare decât activitatea de sulbactam. derivați ai acidului clavulanat și penicilinei sunt de asemenea activi împotriva anumitor beta-lactamaze de clasa D, activitate împotriva clasei C au scăzut sau absent.
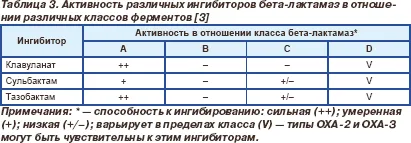
Clavulanatului a fost primul inhibitor de beta-lactamază, a primit utilizarea clinică. El este foarte activ împotriva beta-lactamază de clasa A, in special cromozomiale beta-lactamază de Bacteroides spp. C.diversus, Klebsiella spp. P.vulgaris. P.mirabilis, catarrharalis Moraxella, penicilinazele stafilococice, precum și TEM de beta-lactamază și SHV, care sunt adesea produse de membrii familiei Enterobacteriaceae. Haemophilus influenzae. Neisseria gonorrhoeae. Deși există o creștere constantă ca urmare a producției de beta-lactamază, cele mai importante clinic beta-lactamaze își păstrează sensibilitatea la clavulanat (tabelul. 2). [3]
Clavulanatului prezintă, de asemenea, propria sa activitate antibacteriană împotriva bacteriilor Gram-pozitive și Gram-negative și anaerobi, mecanismul acestei activități nu este asociată cu inhibarea beta-lactamază (tab. 4) [10]. Clavulanatului prezintă cea mai scăzută activitate împotriva Pseudomonas aeruinosa și enterococi mai pronunțat - în ceea ce privește Enterobacteriaceae și H.influenzae, majoritatea - împotriva Bacteroides fragilis și alte anaerobi, M.catarrhalis. stafilococi și streptococi. Clavulanat este de asemenea activ împotriva Neisseria spp. și prezintă o bună activitate împotriva bacteriilor atipice, cum ar fi Chlamydia spp. și Legionella spp. [10].
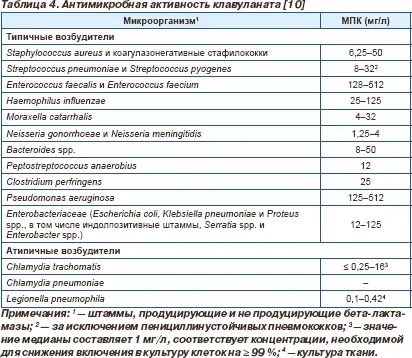
Activitatea clavulanat a fost investigat în asociere cu alți agenți antimicrobieni, inclusiv penicilina si ticarcilina, dar ca amoxicilină / clavulanat este cel mai frecvent utilizate combinatie, cele mai multe studii au investigat activitatea clavulanat este combinată cu amoxicilină.
Din punct de vedere clinic, interes este antipnevmokokkovaya activitatea de amoxicilină / clavulanat, așa cum sa observat în unele regiuni, creșterea rezistenței Staphylococcus pneumoniae este principala preocupare. Studiile in vitro au arătat că acidul clavulanic poate crește antipnevomokokkovuyu activitatea antibioticelor beta-lactamice datorită legării suplimentare de PSB. De exemplu, adăugarea clavulanat reduce concentrația minimă inhibitorie (CMI) a penicilinei la 1/3, iar penitsillinustoychivye tulpinile pneumococice in prezenta schimbarea formei și volumului celulelor microbiene sale. Astfel, DPM suplimentar de legare atașat de amoxicilină / clavulanat mai pronunțată comparativ cu activitatea amoxicilina antipnevmokokkovuyu [10].
Clavulanatului are de asemenea mare activitate in vitro împotriva Legionella pneumophila. în care sinergism între klavaulanatom și amoxicilina împotriva acestui patogen este cauzată nu atât de mult beta-lactamază activitate clavulanat (legionella produce un beta-lactamază cu activitate redusă), dar legarea suplimentară a clavulanatului și amoxicilina cu PDM. Cu mai pronunțată în comparație cu peniciline capacitatea de a penetra în interiorul celulelor, mult mai eficient amoxicilina clavulanat acte localizate intracelulară pe Legionella pneumophila [10].
Clavulanatului de asemenea, are capacitatea de a în mod semnificativ, cu 70-80%, reducerea intracelulară de Chlamydia trachomatis. Activitatea clavulanatului împotriva agenților patogeni atipice, identificate in vitro. și a fost confirmat in vivo pe modele experimentale de pneumonie la soareci cauzate de Chlamydia trachomatis și Legionella pneumophila, în care la activitatea pneumonie Legionella de amoxicilină / clavulanat a fost comparabil cu cel al eritromicinei și doxiciclină.
Există, de asemenea, dovezi de activitate mai mare de amoxicilină / clavulanat comparativ cu amoxicilina contra tulpinilor de flora periodontale (Actinobacillus actinomycetemcomitans și Enterococcus faecalis) și E. coli. care nu produc beta-lactamaze.
Eficacitatea clinică a unui antibiotic nu depinde numai de proprietățile antimicrobiene reale ale preparatului, ci și din interacțiunea cu factorii de aparare imunitar al microorganismului. Rezultatele studiilor in vitro au demonstrat îmbunătățirea proprietăților de protecție ale gazdei prin imbunatatirea microbiene celule polimorfonucleare captarea și distrugerea ulterioară a agentului patogen, precum și chemotaxia îmbunătățite și adeziunea celulelor polimorfonucleare. Influența pozitivă a microorganismului amoxicilină / clavulanat asupra răspunsului imun poate avea un efect pozitiv asupra rezultatului clinic al infectiilor pneumococice, in care celulele polimorfonucleare sunt prima linie de apărare [10].
caracteristică pozitivă clavulanatul este independența eficienței sale asupra pH-ului mediului. În plus, amoxicilină / clavulanat (AMO / R) combină proprietățile unui inhibitor de beta-lactamază, o bună biodisponibilitate și spectru larg de activitate antimicrobiană a amoxicilinei, ceea ce face de departe numai peniciline ingibitorozaschischennyh reprezentative adecvate pentru terapia orală. Disponibilitatea formelor pentru administrare parenterală cel mai bun medicament al tuturor penicilinelor ingibitorzaschischennyh pentru terapia secvențială face.
5. Richmond M.H. Sykes R.B. P-lactamazelor ale bacteriilor Gram-negative și posibil a rolului lor fiziologice // Advances in Microbial Physiology. - 1973-9 - 31-88.
6. Lacey R.W. Rezistența la antibiotice în Staphylococcus aureus și streptococi // British Medical Bulletin. - 1984-1940 - 77-83.
7. Livermore D.M. Do p-lactamază cefalosporine capcană? // Journal of antimicrobiana chimioterapie. - 1985. - 15. - 511-4.