punct critic
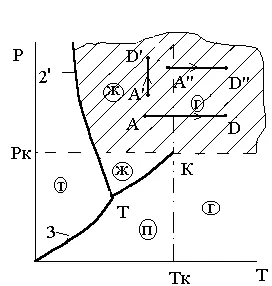
După cum rezultă din P faze Vdiagrammy (fig.3.3) pentru creșterea diferenței de presiune dintre volumul specific al lichidului de fierbere (V „) și vapori saturați uscat (V“ „) scade treptat și la punctul K devine zero. Această stare se numește punct critic K și - punctul critic al unei substanțe.
Pf, Tf, VR, SK - parametrii critici termodinamice ale materiei.
De exemplu, pentru apă:
Vk = 0, 00326 m 3 / kg
La proprietățile punctelor critice ale fazelor lichidă și gazoasă sunt identice.
După cum rezultă din faza T - Sdiagrammy (figura 3.4), la punctul de căldură critic al vaporizării, reprezentat ca aria de sub linia orizontală a tranziției de fază (C „- C“ „), din lichidul de fierbere la aburul saturat uscat. zero.
Punctul K izotermele pentru Tc-in fazovoyP Vdiagramme (fig.3.3) este un punct de inflexiune.
Izotermă Tk. trecând prin punctul K, yavlyaetsyapredelnoy izotermă zona de fază, adică separă faza lichidă din regiunea gazoasă.
La temperaturi de peste Tc izotermele nu au nici porțiuni drepte, ceea ce indică o fază de tranziție, nici punctul de inflexiune caracteristică Tk izotermă. și să ia treptat forma unor curbe netede, similare ca formă izotermelor ideală de gaz.
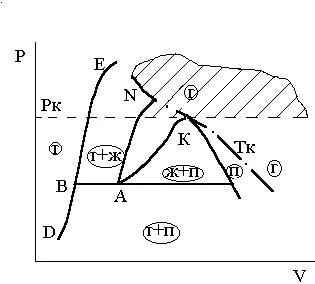
Termenii „lichide“ și „gaz“ (vapori) într-o anumită măsură arbitrară, deoarece interacțiunea moleculelor în lichid și gazul sunt modele comune, care diferă doar cantitativ. Această teză este ilustrată risunkom3.6 în care tranziția de la punctul E la un punct al fazei gazoase a fazei lichide L este produsă în punctul K critic al EFL traiectoriei.

Figura 3.6. Două variante ale tranziției de fază
din gazoasă în faza lichidă
La trecerea prin punctul de substanță C Adv este separat în două faze și apoi, treptat, modificări de substanță dintr-un gaz (vapori) faza la lichid.
La punctul C, proprietățile materialului schimbă brusc (într-o fază de P Vdiagramme punctul C al tranziției de fază a tranziției de fază este transformată într-o linie (C „- C“ „)).
La trecerea prin gazul în lichid EFLprevraschenie are loc în mod continuu, deoarece curba nu intersectează liniyaEFLnigde vaporizarea TC, în care substanța există simultan în două faze lichide și vapori. Prin urmare, atunci când faceți clic pe liniiEFLveschestvo nu se va rupe în două faze și rămâne o singură fază.
Tc Temperatura critică - este temperatura limită de echilibru coexistența celor două faze.
Referitor la procesele termodinamice în sistemele complexe este clasic Tc definiție succintă poate fi desfășurată după cum urmează:
Temperatura critică Tc - este temperatură mai scăzută regiunea de delimitare a proceselor termodinamice în care apariția statului în două faze este substanță imposibilă „gaz - lichid“ sub orice modificări de presiune și temperatură. Această definiție este ilustrată în Figura 3.7 și 3.8. Din aceste cifre rezultă că zona delimitată de o temperatură critică, se referă numai la starea gazoasă (fază gazoasă) materie. Starea gazoasă a materiei, numită abur în această zonă nu este inclusă.
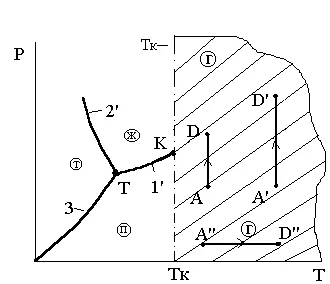
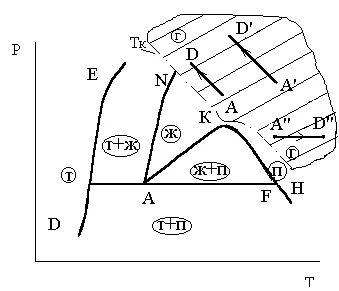
Fig. 3.7. Prin definiție, determinarea critică a Ris.3.8.K critice
Temperatura Temperatura TION
Din aceste cifre rezultă că zona umbrită delimitată de o temperatură critică, se referă numai la starea gazoasă (fază gazoasă) materie. Starea gazoasă a materiei, numită abur în această zonă nu este inclusă.
Folosind conceptul de punctul critic, este posibil de la conceptul general de „materie gazoasă“, sublinia conceptul de „abur“.
Pr - o substanță fază gazoasă în regiunea sub temperatura critică.
Procesul termodinamic când linia de proces sau curba intersecteaza vaporizarea TC, sublimare sau curba 3, este întotdeauna prima faza gazoasă este abur.
Presiunea critică Pk - este presiunea peste care separarea în două substanțe coexistă simultan în mai multe faze de echilibru: lichid și gaz nu poate fi la orice temperatură.
Aceasta este definiția clasică a Pk. în ceea ce privește procesele termodinamice în sistemele complexe pot fi formulate mai în detaliu:
Presiunea critică Pk - este partea de jos a limitei de presiune a proceselor termodinamice în care apariția statului în două faze este substanță imposibilă „gaz - lichid“ sub orice modificări de presiune și temperatură. Această definiție ilustrează ris.3.9 presiune critică. și 3.10. Din aceste cifre rezultă că zona delimitată de presiunea critică, nu numai că acoperă o parte a fazei gazoase, situată deasupra isobars Pk. dar, de asemenea, o parte a fazei lichide sub Tk izotermă.
Pentru regiunea supercritic pentru probabilitatea (condiționată) de frontieră „lichid-gaz“ acceptă condiționat izotermă de critică.
definition Ris.3.9.K puncte critice - Ris.3.10. Determinarea critice
Cine presiune
Dacă presiunea de tranziție este mult mai mare decât presiunea la punctul critic, substanța unui (cristalin) în stare solidă va trece direct la o stare gazoasă, fără a trece printr-o stare lichidă.
De la P-T diagramele de fază substanță atipică (Fig 3.6, 3.7, 3.9) nu este evident, deoarece ele nu sunt arătate partea diagramei, în care substanța având o presiune ridicată la o serie de modificări cristaline (și, prin urmare, mai multe puncte triple) își asumă din nou proprietățile normale.
La faza de P - diagrama T substanțe normale Fig. 3.11 trecerea de la faza solidă în stare de gaz imediat prezentat ca un A'D proces“.
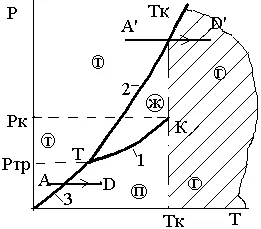
Fig. 3.11. tranziție a valorilor normale
substanțe din faza solidă direct în
gazos la P> FFR
Trecerea de la faza solidă la vapori, ocolind lichidul, este atribuit doar atunci când R<Ртр. Примером такого перехода, называемого сублимацией, является процесс АDна рис 3.11.
Temperatura critică este un molecular foarte simplu - interpretarea cinetică.
Combinații de molecule se deplasează liber în picătură de lichid la lichefierea gazului are loc în mod exclusiv sub efectul forțelor de atracție reciproce. Când T> Tc energia cinetică a mișcării relative a celor două molecule au mai atracția energie a acestor molecule, astfel încât formarea de picături lichide (adică, coexistența celor două faze) este imposibilă.
Puncte critice sunt doar curbele vaporizarea deoarece acestea corespund coexistenței echilibru a două faze izotrope, lichid și vapori. Liniile de topire și sublimare au puncte critice, ca ele corespund acestei stări cu două faze a substanței în cazul în care una dintre faze (solid) yavlyaetsyaanizotropnoy.
