Principiul minimei energiei - configurațiilor de electroni ale atomilor - structura atomica si legi periodice
In atom fiecare electron este localizat, astfel încât energia sa a fost minimă (care corespunde nucleul cel mai mare comunicare sale).
Energia electronilor este determinată în principal de principal număr cuantic n și un număr cuantic secundar l. Cu toate acestea aceste subnivele mai întâi umplut, pentru care suma numerelor cuantice n și L este cel mai mic. De exemplu, energia electronului 4 la subnivel s mai puțin decât subnivel 3 d. deoarece în primul caz, n + 1 = 4 + 0 = 4, iar al doilea n + l = 3 + 2 = 5; subnivel 5 s (n + l = 5 + 0 = 5), energia este mai mică decât 4 d (n + l = 4 + 2 = 6); 5p (n + l = 5 + 1 = 6), energia este mai mică de 4 f (n + l = 4 + 3 = 7), etc.
VM Klechkovskii prima dată în 1961 a formulat o dispoziție generală care să ateste că electronul ocupă nivelul solului de stat este valoarea minimă posibilă a n. iar cea mai mică valoare a sumei n + l.
În cazul în care cele două subnivele pentru suma valorilor l și n sunt egale, primul subnivelul este umplut cu o valoare mai mică n. De exemplu, în subnivele W d. 4p, 5s suma l și n este 5. In acest caz, primele subnivele de umplere cu valori mai mici ale lui n. și anume W d - 4p - 5 s, etc. Sistemul periodic al elementelor din secvență periodică electronilor de umplere nivelurile și subnivele după cum urmează
În consecință, în conformitate cu principiul de energie minim, în multe cazuri, energia de electroni este mai profitabil să ia un sub-strat de nivel „suprapusă“, în timp ce subnivelul „care stau la baza“ nivel este gol
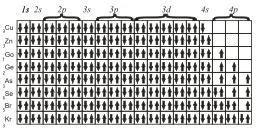
Acesta este motivul pentru care, în a patra perioadă este mai întâi umplut subnivel 4 s și numai după acest subnivel W d.
Următorul element al acestei perioade - 24 C r. Pe baza a trei dispoziții principale - principiul Pauli, regulii lui Hund și principiul energiei minim - configurația electronică poate fi reprezentat ca
Deși unele anomalii și configurația electronică reală este oarecum diferită (și chiar de la un element 29, C r) este de fapt în 24 atom Cr detectat.
Pentru atomii de Mn. Fe. Și N-am cu configurații electronice sunt după cum urmează
În cele din urmă, ultimele opt elemente ale perioadei a patra au configurație
Principiul cel mai scăzut de energie este valabilă numai pentru statele de la sol ale atomilor. Stările excitate de electroni pot găsi ulterior la orice orbitali de atomi, în cazul în care nu rupt principiul de excluziune al lui Pauli.