prelegere №12
Proteine - biopolimeri complexe, care sunt monomeri -aminoacizi. Ca parte a proteinelor din corpul uman se găsesc numai 20-aminoacizi. Proteinele individuale este determinată de aminoacizi din proteina de ordine alternante. Proteinele sunt cele mai importante clase de compuși biologici. Acestea joacă un rol-cheie în celulă, sunt prezente ca componente majore în toate formele de materie vie, astfel încât este încă definiția de netăgăduit a Engels că „viața este un mod de existență a corpurilor de proteine.“ Proteinele sunt extrem de diverse în structura și de a efectua mai multe funcții biologice. Astfel, într-un singur organism Escherichia Solli conține mai mult de 3000 de proteine diferite.
Denumirea proteinelor obținute din albușul de ou, care din cele mai vechi timpuri a fost folosit ca hrană.
Proteinele cu greutate moleculară variind de 5000-1 milioane sau mai mult. Proteinele sunt enzime, hormoni, antibiotice, toxine. Proteinele indeplinesc o varietate de funcții: catalizatorului (enzimă) transport, motor (actină, miozină) (hemoglobină, mioglobinei, citocromii), de protecție (imunoglobuline, antigene, fibrinogen) receptor (rodopsina), regulatori (histone, represori) ciorap (cazeină, ovalbumina) funcţia energetică este realizată prin stocarea proteinelor sau a altor condiții de repaus alimentar prelungit sau munca muscular prelungit intens.
moleculă relativ mică, cu o greutate de până la 5000 sunt numite peptide sau pentru a include unii hormoni (vasopresină, hormon adrenocorticotrop), glucagon, neuropeptidele cerebrale (endorfinele), peptide de somn, memorie, etc. Alcaloizi (ergotamină) antibiotice (gramicin)
I. -aminoacizi
-Amino - compuși heterofuncționale ale căror molecule conțin o grupare carboxil și o grupare amino într-unul și același atom de carbon. În cele mai multe AK, carbonul - centrul chiral. AA, care sunt monomeri de proteine, are o rudă - configurație L. Configurația este definită printr-un prim atom chiral (-carbon).
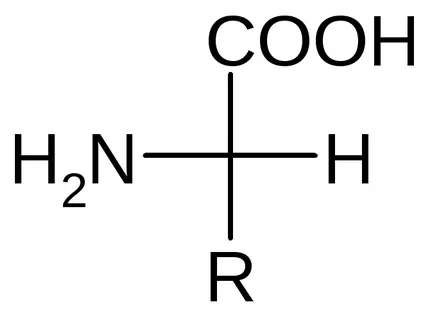
Toate -AK parts un fragment sau un „bloc“ și sunt caracterizate printr-un radical de atom -carbon. Nu numai glicină radical, este un atom de hidrogen în schimb radical.
1. Intervalul de aminoacizi și clasificarea și structura lor de radicali
Numele pentru AK este utilizat de preferință triviale (glicină din cuvântul -glykos dulce, serina din cuvântul serieum - matasoasa, mătase obținută din fibrina), pentru înregistrarea folosind denumirea lor de trei litere. În componența lanțului polipeptidic al AK rest având nici o grupare carboxil în blocul de construcție se numește cu schimbarea închidere -in-il. De exemplu, în loc de glicil glicin etc.
Conform structurii radicalilor schelet de carbon AK împărțit în hidrocarburi alifatice, aromatice și heterociclice. Ca parte a radicalilor pot fi grupări funcționale, oferindu-le proprietăți specifice: carboxil, amino, tiol, amidice, hidroxil, guanidino. AK ele însele toate sunt solubile în apă, dar proprietățile părții de proteină a radicalului solubilitatea influenței proteinelor în apă, astfel încât AA cu radicalii nepolari hidrofobi forma proteine insolubile (colagen), AK cu radicali polari hidrofile formează proteinele solubile în apă (albumina). radicali de hidrocarburi hidrofobi această structură, care sunt capabile „lipite“ împreună pentru a forma legături hidrofobe, dar nu formează legături de hidrogen cu apă și, prin urmare, nu se dizolvă în ea. Acestea includ radicali cu legături nepolari (radicalii hidrocarbonați). Radicalii hidrofile au legăturile polare formă și obligațiuni dipol-dipol sau hidrogen cu apă. Radicalii hidrofobe și hidrofile AK determină structura spațială a proteinei la care aparțin.
Printre radicalii polari produc, de asemenea, o sarcină (pozitivă și negativă), ele sunt mai solubile în apă și neîncărcate, se dizolvă în apă și mai rău.
Tabel. Structura aminoacizilor - monomeri proteine
1.AK radicali hidrocarbonați alifatici (hidrofobă)