Potențialul de electrod
Potențialul de electrod se produce la nivelul umerilor freca la limita veniya-metal cu un lichid, cum ar fi apa sau apoase-rase creează sarea metalică. Simbolul unui sistem z M + / M, în care M + z - cationi potențial metal (formă oxidată), notează caracteristica delimitările secțiunilor soluție - fază solidă, M - metalic (forma redusă).
Considerăm că procesele care au loc în timpul de imersie UI taliu în apă. Între cationii metalici din zăbrele pe suprafața metalică și dipolii apă forțe electrostatice apar interacțiunea ion-dipol. Aceste cationi ki energia cinetică termică, care este suficient de mare circulație, detașat de suprafața metalică din cauza hidratare si ...
transferat în apă (reacția de oxidare). Astfel UI taliu sarcină negativă din cauza excesul de electroni rămase, iar apa - este pozitiv datorită trecerea ei în cationii metalici. Desigur, în procesul de tranziție în timpul cationilor do însoțită de un proces invers - dehidro-ted cationi ai metalelor de tranziție din soluția apoasă rezultată la suprafața metalică (reacție de reducere). În general, această ecuație poate fi exprimată proces redox:
Când metalul este scufundat în apă pură în momentul inițial de timp, rata de eliberare a cationilor maxime și viteza minimă de intrare, astfel încât percolarea Ca cationi metalici de oxidare vitezei de ieșire de proces scade, iar intrarea lor în cursul fazei solide este crescută ca urmare a DES și interacțiunea cu el ioni. După ceva timp, viteza de ieșire și de intrare cationi vayutsya-egalizare și echilibru stabilit în sistemul DES, în care suprafața metalică este încărcată negativ, iar soluția - pozitivă (Figura 25.1, a.). Steady caracterizat DES-zată potențial electrod de echilibru.
În cazul în care metalul nu este scufundat în apă pură și o soluție apoasă a unei sări a acestuia, în funcție de natura metalului și concentrația (activitatea) a ionilor în soluție este posibil ca la începutul ratei de cationi ai metalelor de tranziție în soluție va fi mai mică decât rata de depunere pe suprafața metalică, adică. e. .În acest caz, deoarece beneficiile originale ale reducerii cationilor metalici liber samoproiz are loc la echilibru th DEL, în care metalul este încărcat pozitiv, și testat soluția negativă (fig. 25.1, b).
În consecință, prin cationii metalelor de tranziție de suprafață a metalului Th-cut - soluția este întotdeauna formată și există un potențial de electrod DES. Magnitudinea potențialului electrodului de p-TION (M + z / M) care apar la -solution metalic depinde de următorii factori:
- natura metalică (energia zabrele, energia de ionizare a atomilor de metal și energia de hidratare a acestuia ka-tione);
- activitate (concentrație efectivă) a ionilor potențiali care determină în soluție;
- temperatura soluție.
Potențiale apărute în sistem în condițiile standard-condiți, și se numește standardul notat f ° (M + z / M +).
Potențialul Xia standard de electrod potentsialomnazyvaet apar la curse --create metalice asupra activității potențiale ioni în soluție 1 mol / l și o temperatură de 298 K.
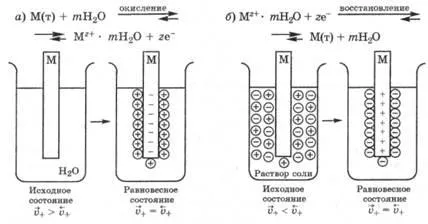
Fig. 25.1. Apariția potențialelor de electrod:
și - atunci când metalul este scufundat în apă pură; b - când este imersată-mi-sa de soluție de sare de taliu
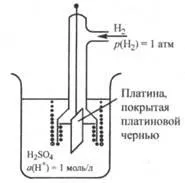
Fig. 25.2. electrod standard de hidrogen
Valoarea absolută a primului electrod potențial standard a unui singur electrod pentru a măsura sau conta-curse nu poate fi, dar poate fi definit, de a împărtăși sensul său cu privire la orice electrod selectat ca referință. În conformitate cu Acordul internațional pentru acest așa-vaginul este un electrod standard de apă-țional.
In electrochimie interval folosit de potențiale standard definite în raport cu un potențial standard de electrod de hidrogen, valoare care presupune în mod convențional ca fiind zero.
electrod standard de hidrogen este o placă pla-tinovuyu acoperit cu negru de platină (loose pla-slime), și coborâtă în soluția acidă, în care activitatea ionilor de hidrogen este de 1 mol / l, și prin care tot timpul scurs este foarte curat, gazul de hidrogen sub o presiune de 1 atm ( 101325 Pa) (Fig. 25.2).
Simbol electrod standard de hidrogen:
In hidrogen reversibil apar procese de electrod:
Potențialul de electrod standard de hidrogen adoptat în mod convențional ca zero la toate temperaturile:
Trebuie remarcat faptul că electrodul de hidrogen nu este foarte ușor de utilizat, dar este important într-un sens termodinamic, deoarece servește ca standard primar, care este definită în ceea ce privește fisionabil potențiale ale altor electrozi. În practică, în locul unui electrod de hidrogen ca un electrod de referință este utilizat pe scară largă de argint aranjament electrod clorură și funcționarea Koto-cerned vor fi discutate în Sec. 25,6.
Pentru a determina potențialul de electrod al unui electrod în raport cu un hidrogen nical standard, constituie circuitul Galve (elementul) din cele două jumătăți de celule: electrodul de testare și un electrod standard de hidrogen.
circuit electric este un sistem închis-mu, format din doi electrozi conectate printr-un circuit extern - un conductor electronic (metal) și său interior lanț - conductoare de ioni (soluții electrolitice, punte de sare Cpd-nennye). Circuitul galvanic transformarea proceselor energetice chimice de oxidare și de reducere a energiei electrice. Circuitul galvanic distinge electrozi: anod și catod.
Anodomv electrochimie se numește electrod pentru reacția de co-oxidare are loc torus, t. E. Recoil electroni tronuri.
Anodul circuitului galvanic este încărcată negativ, și trimite electronii într-un circuit extern. Anodul este întotdeauna materialul electrodului care oxidat, de exemplu, mai mult metal activ. Spre deosebire de anod, soluția anod datorită acumulării în acesta, un exces de cationi încărcat pozitiv.
Katodomv electrochimie numit electrod pentru a co-reducere are loc reacția torus, t. E. Pryce-unire a electronilor.
Catodul circuitului galvanic este încărcat pozitiv și primește electroni din circuitul exterior. Catodul este elec-trodes cationilor metalici mai puțin active ușor restaurate. Spre deosebire de catod, soluția catod în Gal-lanț vanicheskoy încărcate negativ din cauza acumulării de anioni în ea.
Trebuie reamintit faptul că atunci când se analizează electro-Lease (atunci când energia electrică este transformată într-chimic) natura proceselor care au loc la electrozi este menținută, iar anod și catod sunt inversate semne.
Când callout anod galvanic Vo ice catenei ik- stânga, dreapta catod. Interfața între un electrod și o soluție în care este omisă o linie desemnată, și o punte de legătură electrolitică anodice și catodice soluțiile indicate prin două caracteristici:
Când circuit închis galvanic în ea datorită reacției spațiu-diviziune-guvernamentală oxidare (anod) și recov-TION (catod) se produce mișcarea direcțională a electronilor de la anod la catod printr-un circuit extern, și - ionii lanțului interior (pod electrolitic). Datorită apariției pe - mișcarea direcțională a particulelor încărcate în circuitul galvanic deține conversia reacțiilor chimice-oxidativ de reducere a energiei în energie electrică. Astfel, la timp, circuitul galvanic pot fi surse de curent Kami chimice.
Capacitatea circuitului galvanic pentru transferul sarcinilor electrice caracterizat prin forță electromotoare (EMF).
Tsepiopredelyaetsya forță electromotoare galvanic ca diferență de potențiale de catod și anod: fk = E - F.
Circuitul galvanic funcționează potențial spontan anod este întotdeauna mai mică decât potențialul catodic și forța sa electromotive - au fost rang pozitiv (E> 0).
Măsurarea potențiale de electrod. Dacă circuitul măsurat emf galvanic constând din test și electrod standard de hidrogen, este posibil să se determine valoarea de electroni - potențial de electrod al electrodului de test.
Valoarea potențialului de electrod numeric egală cu circuitul galvanic EMF compus dintr-un standard in-voluminoasă electrod și potențialul de electrod care trebuie determinată și are un semn „+“ în cazul în care fluxurile de proces de recuperare, iar semnul „-“ în cazul în care procesul de oxidare.
Luați în considerare câteva exemple. Se determină potențialul de electrod valoare mill standard de zinc a scăzut în soluția de sare de zinc, în care cationii activitatea unui (Zn2 +) = 1 mol / l. Ca zinc este oxidat mai ușor decât hidrogen, electrodul galvanic de zinc circuit cal este anod și un electrod standard de hidrogen - (. Figura 25.3) catod.
Scriem de circuit compus Lanțuri galvanice
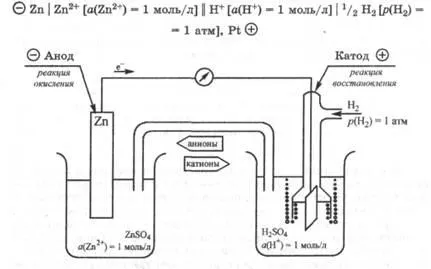
Fig. 25.3. Circuit electric pentru măsurarea capacității de electroni standard de electrod al electrodului de zinc
Acest circuit de EMF galvanic egal cu diferența dintre potențialele și anod catod:
Definim potențialul standard al electrodului de cupru, în cazul în care EMF circuitul galvanic compus din electrod determinată standard de hidrogen și este egală cu 0,34 V.
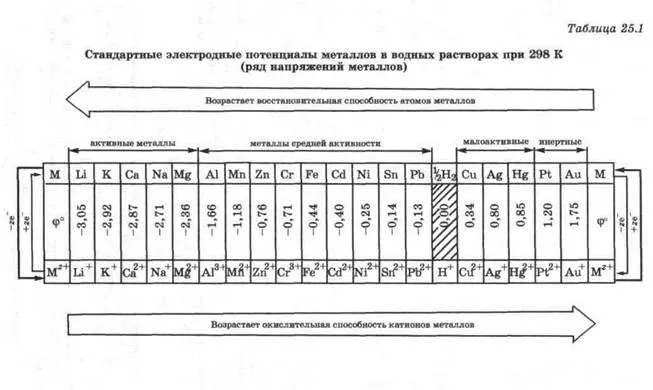
Amploarea potențialului de electrod standard ha metalic caracterizează capacitatea sa de a dona electroni, și are o constantă yannoe pentru fiecare valoare de metal. Potențialele de electrod standard de metale sunt prezentate în tabelul. 25.1.
Mai multe metale napryazheniy- în această locație într-un rând crescând potențialul lor de electrod standard sunt.
Printre aceste metale de tensiuni care donează electroni mai ușor decât hidrogen, sunt lăsate de hidrogen și au un rezultat negativ de valori ale potențialelor de electrod standard. Aceste metale, care donează electroni mai dificil decât hidrogen, sunt la dreapta hidrogenului au valori pozitive și standard de electroni electrod potențial. Cu cat valoarea f ° (M + z / M), metalul-ac tive.
ecuația Nernst. Valoarea potențialului de electrod, un cos-permeating la metal - soluția depinde de natura metalului, activitatea sa de ioni într-o soluție și temperatura. Efectul tuturor acestor factori asupra amplitudinea potențialului de electrod de metal Nogo este exprimată prin ecuația Nernst:
unde f ° - potențial de electrod standard de; R - constanta universală a gazelor, 8,31 J / (mol • K); T - temperatura, K; r - Potențialele de încărcare ioni tsialopredelyayuschih-metalici; F - numărul lui Faraday, 96.500 C / mol; și (M + z) - Activitatea ionilor de potențial metalici în soluție în mol / l.
Dacă introduceți valorile numerice ale constantelor R și F și du-te de la logaritmi naturale în zecimal, ecuația Nernst devine: