Pirol - Enciclopedia chimică
Pirolil. spun ei. 67,09 m .; bestsv. lichid cu un miros de cloroform. se închide la culoare încet în picioare în aer; t. baloți. 130 ° C, pt. -23.4 0 C; 0.9698; 1.5086; m 5,17 · 10 -30 m · Cl (în cantitate pură), 6,00 · 10 -30 m · CI (apos benzen la ciclohexan.); -2364.2 kJ / mol. Higroscopic, miscibil în toate privințele cu majoritatea org. r solubilitate rău -riteley. în apă (6 g în 100 g de apă la 25 0 C). Molecule pirol plat, polar, dipol-direcție de la atomul de N al inelului interior. Pirol-geteroaromatich. conn.; aromatic. Sistemul este format din două perechi de electroni de legături duble și perechea lone atom N de electroni (p -izbytochny heterociclu). Pirol-N H acid (pKa 17,5, apa). In procesarea Na sau K sau amide în NH3 lichid. și p-TION cu un metal într-un inert p-ERATOR preparat Na- și K sărurile pirol, la- alchilat și acilat N. sare atom de litiu este preparat prin reacția pirol cu Li în NH3 lichid sau butii- sau fenillitiu într-un eter p -Re. N-substituiți butil- metalat pirol sau fenillitiu în poziția 2 cu un reactiv Grignard în eter pirol formează ușor derivați N-pirrolmagnievye, la- alchilat și acilat la C-2. Pentru pirol caracteristică electrofil p-TION. substituție preim la-. sunt pe un atom de carbon. Protonare miner pirol. la-ter duce la o perturbare a sistemului și determină polimerizarea aromaticității (m este format. numit piro roșu.). Nitrarea acetil pirol conduce la amestec 2-nitropirol cu 3-nitro; sulfonarea complex piridină-SO3 la 100 0 C pentru a forma pirol-2-sulfo-acizi. Când p-TION halogen pirol tetragalogenpirrol foarte ușor format. halogenuri active (alil și benzii halogenuri) în prezența. baze slabe pirol alchilat în poziția 2 și 5, CH3 I la 100-150 0 C, și, de asemenea, în poziția 3 și 4. Acilarea anhidridă acetică pirol la 100 0 C, se obține un amestec de 2-acetil și 2,5-diatsetilpirrolov. Prezența în poziția 1 cu o grupă fonilnoy-electron fenilsul schimbă orientarea electrofil. substituție: acilarea 1-fenilsulfonilpirrola Friede-lu-Crafts este selectiv în poziția 3. Sub acțiunea HCN, HCI și POCI3 în DMF, CHCI3 sau într-un mediu alcalin este formatat pentru a forma pirol-2-formil-pirol. Atunci când se utilizează CHCl3 datorită formării dichlorocarbene este incidental p-TION pentru a forma 3-cloropiridină:
Pentru p-TION pirol Mannich convertit. 2-dialchilaminometil-piroli. Cu activat. alchene (esteri acrilici în-vă, acrilonitril. anhidridă maleică și altele.) în prezența. la t-pirol sau baze intră în p-TION, cum ar fi p-TION Michael, cu formarea de produse de alchilare în pozițiile 2 și 5. în încălzire. cu p-rom apos (NH4) 2 CO3 carboxilații pirol presurizat la sare de amoniu pirol-2-carbonil-to-you urlând. În mediu neutru sau slab acid intră în cuplaj p-TION azo pentru a da derivații 2-azo în medii alcaline dă bis-azo derivați ai, de ex.:
Cu acetonă într-un mediu acid formează un pirol ciclic. tetramer f-ly I.

La moderat t-D și o presiune ușor pirol hidrogenat în pirolidină (kat.-Pt, Pd, Ni-Raney). Prin reducere cu Zn și HCI m. B. izolat 3-pirolină. Aerul din pirolul luminii este oxidat la succinic imida la tine, crom-la-unu în maleimidei.
P-D n dimetilaminobezaldehidă acid clorhidric (reactiv Ehrlichs) pirol produce o culoare roșie, cu SeO2 în soluție apoasă p-D - violet cu isatină formează un precipitat albastru. Pirol identificat în general ca un complex cu HgCl2 (cu punctul de topire 143 0 C).
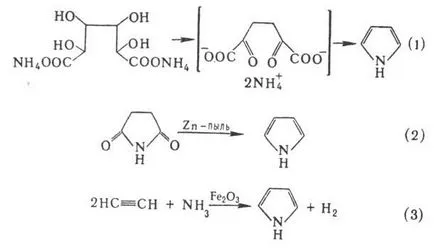
Preparat distilare pirol sare de amoniu mucic-vă (varianta de sinteză Paal-Knorr, p-TION 1) distilarea da succinice la tine cu pulbere de zinc (2) care trece NH3 prin acetilenă și calcinat în tubul de prezență. oxizi de Fe (III) sau Pb (3), katalitich. amonoliză furan sau tiofen în prezența. 2O 3 (p-TION Yureva):
N irrol moderat toxic; vaporii săi cauzează o creștere persistentă și persistente în organism așa-riu; LD50 74 mg / kg (iepuri, p.o.).
N irrol utilizat pentru sinteza pirolidină și a anumitor lek. Wed-in. Acesta a fost deschis primul F. F. Runge în anul 1834 în kam.-ug. rășină; obținut în formă pură T. Anderson în 1858 în coarne de distilare uscată și ongloanelor.
Lit. chimia organică totală. per. din limba engleză. Vol. 8, M. 1985, p. 332-88; Gossauer A. Die Chemie der Pirol, B. 1974; J cele R. A. Fii n G. P. Chimia piroli, N. Y.-L. 1977; Anderson H. J. Loader C. E. "Synthesis", 1985, N 4, p. 353-64. M. A. Yurovskaya.