molecula de hidrogen
Diagrama arată formarea moleculelor de hidrogen. Dintre cele două 1s - orbitalii doi atomi de hidrogen având orbitali moleculari. Un σ1ssv de legare sigma. alte sigma antibonding σ1srazr. Lipirea orbital are o energie mai mică decât orbitalii atomice originale și antibonding mai mare. Prin urmare, electronii se deplasează la lipirea orbital - vezi figurile 7 și 8 ..
2 H (1s1) → H2 [(σsv.1s) 2] - 435 kJ
Reducerea energiei de tranziție a electronilor cu atomic la orbitali moleculare și permite formarea de legături chimice și, în consecință, molecula de hidrogen.
Fig.7 Educația molecular orbital al moleculei de hidrogen
Figura 8. Formarea legăturii de hidrogen orbitală a moleculei
Metoda MO ne permite să explicăm existența H2 + ion. Dacă acesta formează un singur electron este transferat la orbitalii atomice 1 s la lipirea σsv.1s orbitali care este energetic favorabil și este însoțită de eliberarea de energie:
H (1s1) + H + → H2 + [(σsv.1s) 1] + 259 kJ
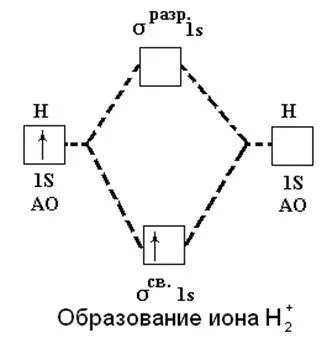
Figura 9. Formarea de ioni de hidrogen
Metoda MO, de asemenea, explică de ce nu există unele particule. De exemplu, observat experimental molecular ion He2 +. Dintre cele trei electroni în componența sa două legare ocupă (σ1ssv.), Din care 2 energia orbitală este mai mică decât 1s orbitali și antibonding inițiale σ1s una de evacuare, sursa de energie care este mai mare decât 1s orbitali. Ca rezultat, energia ionului molecular de heliu este mai mică decât energia totală a originalului atom și heliu ion, ceea ce determină posibilitatea existenței sale. Cu toate acestea, în molecula He2 heliu, în cazul în care a existat, numărul de electroni de pe orbitalii de legătură și antibonding ar fi la fel și egal cu doi. Prin urmare, câștigul de energie în comparație cu energia totală a celor doi atomi de heliu nu poate, din acest motiv există molecule de heliu.