Metoda cumen pentru producerea de fenol
la lista de prelegeri
la lista de articole
Metoda cumen pentru producerea de fenol.
Fenolul C6 H5 OH este o substanță cristalină (t p.t. = 42 0 C, t refluxarea = 181,4 0 C) în formă proaspăt distilat este incoloră. Dar stocarea devine o culoare portocalie sau roșie profundă.
Direcțiile principale de aplicare a acesteia - producerea de rășini fenolice, fibre sintetice, nailon și nailon, rășini epoxidice și policarbonații. Este, de asemenea, utilizat ca intermediar în producerea de coloranți, droguri și explozivi, ierbicide. fenol preparat prin alchilarea aditivi antioxidanți și intermediari pentru sinteza agenților tensioactivi neionici.
Metoda cea mai avansată pentru producerea de fenol, cumen se bazează pe punerea în aplicare a următoarelor etape:
1. Oxidarea izopropilbenzenul (cumen) hidroperoxid
2. Extinderea hidroperoxidul rezultat la fenol și acetonă
Ecuațiile sumatoare (1) și (2) obținem ecuația procesului rezultați
Se poate observa că partea din dreapta din totalul (3) implică numai fenol și acetonă, care sunt produse comerciale valoroase. Pe de altă parte, în acest proces necesită materii prime ieftine și accesibile (izopropilbenzen și aer). Acest lucru face ca procesul de cumen pentru prepararea unei mai economic între toate metodele cunoscute pentru producerea de fenol.
Luați în considerare etapele de bază structura fluxului de oxidare și descompunerea hidroperoxidului izopropilbenzen.
Oxidarea izopropilbenzenul (cumen)
Oxidarea izopropilbenzenul este un proces radical liber tipic cu ramificare cu lanț degenerate. În absența oricăror agenți externi care inițiază circuite nucleatie efectuate prin interacțiunea bimolecuă moleculelor de oxigen si izopropilbenzenul
Această reacție se caracterizează prin bariera energetică ridicată și este lent. Rata scăzută de inițiere nu poate furniza concentrația de radicali liberi la un nivel care cauzează un proces semnificativ lanț scurgere.
Deoarece izopropilbenzenul hidroperoxidul descompune cu ușurință în legătura slabă oxigen-oxigen
acumularea acestuia în proces duce la creșterea ratei de generare avalanșă de radicali liberi și, prin urmare, rata de oxidare a izopropilbenzen. O astfel de natura procesului determină prezența unei anumite perioade de inducție a reacției, care poate fi definită ca timpul în care sistemul se acumulează hidroperoxid furnizarea apreciabilă proces lanț scurgere. În acest sens, modul natural de a reduce perioada de inducție este de a adăuga o anumită cantitate de pornire hidroperoxidul izopropilbenzenul sau masa de reacție oxidat.
Perioada de inducție a procesului poate fi semnificativ mai lung datorită prezenței în masa de reacție a inhibitorilor de oxidare a radicalilor liberi, cum ar fi compuși cu sulf organici, fenoli, etc. În acest caz, perioada de inducție este determinată ca timpul în care sistemul este distrus inhibitor J -. H datorită sale interacțiunea cu radicali cu catenă
R × + J - H ® RH + J x
Radicalii astfel formați J x inactive și nu mai poate continua în continuare a lanțului. Datorită determina o creștere marcată în perioada de inducție importantă problemă tehnologică este de curățare a materiei prime de la substanțe care sunt inhibitori sau capabile de a da la inhibitori de oxidare.
(. săruri de mangan, cobalt, etc.), catalizatorii convenționali de oxidare în fază lichidă, în acest caz nu poate fi folosit ca agenți de inițiere, deoarece acestea vyzyvaeyut descompunerea apreciabilă a hidroperoxidului în produsul secundar - dimetilfenilcarbinolului.
Procesul de oxidare a hidroperoxidului izopropilbenzenul într-o formațiune complicată de subproduse: acetonei și dimetilfenilcarbinolului. principale și secundare Reacțiile pot fi prevăzut de următoarea schemă
În conformitate cu schema reprezentată de selectivitate diferențială a hidroperoxidului în proces exprimat prin ecuația
În starea de echilibru
cu toate acestea, deoarece greutatea specifică a acetofenonei în acest proces este mic, membru r 2 în ultima ecuație poate fi ignorată
Apoi, raportul dintre concentrațiile exprimate prin ecuația
Substituind ultima expresie în ecuația (4), avem în sfârșit
Analiza acestei ecuații arată că selectivitatea reacției scade odată cu scăderea presiunii parțiale de oxigen și de a crește gradul de conversie (care corespunde acumulării de hidroperoxid și de a reduce concentrația de hidrocarburi). În conformitate cu o energie scăzută a reacțiilor de activare ale principalelor lanțuri de procesului de comparare cu partea E4> E 1 și E 2> E 3, selectivitatea crește odată cu scăderea temperaturii de proces, dar scade viteza. Acest lucru face necesară pentru a selecta temperatura optimă. În practică, procesul se desfășoară la temperaturi de 105-120 ° C. Dacă procedeul se realizează într-un reactor în cascadă, temperatura de proces este coborât în trepte, la trecerea de la un reactor la altul. O astfel de soluție permite, menținând în același timp viteza de proces (prin creșterea concentrației de hidroperoxid) crește selectivitatea procesului.
Creșterea presiunii conduce la o creștere a vitezei și selectivitatea procesului. În același timp presiunea este limitată de mai sus în legătură cu condițiile mai stricte ale echipamentului, o creștere a costurilor de comprimare a gazelor limite expansiune explozivă a amestecului de vapori de gaz peste masa de reacție. În practică, lucrează cu o presiune de 0,3-0,5 MPa.
Timpul de reacție este determinată de conversie optimă. Crescută de conversie (corespunzătoare epuizării și ROOH acumulării RH) conduce, în conformitate cu ecuația (5), pentru a scădea selectivitatea.
conversie redusă avantajoasă din punct de vedere al selectivității conduce la o creștere a proporției de izopropilbenzen nereacționat, care necesită costuri suplimentare pentru reciclarea acestuia. Conversia optimă, ceea ce reprezintă un compromis între cerințele de selectivitate și de reciclare economică este de obicei 25-30%. Aceste valori corespund timpului de reacție de conversie de mai multe ore.
Datorită reactivității ridicate a procesului izopropilbenzenul în condiții specifice pot apărea în regiunea de difuzie. In acest caz, concentrația scăzută de oxigen în masa de reacție, conform ecuației (5) determină scăderea selectivității procesului. Prin urmare, o problemă tehnologică importantă în procesul de implementare este crearea unui regim hidrodinamic eficient.
Această problemă este rezolvată prin crearea unui mod de circulație masă de reacție prin efectuarea unui proces de aparate extrem de eficiente de transfer de masă.
Prezența impurităților acide în masa de reacție a procesului de descompunere determină nedorită a hidroperoxidului fenol, care este un inhibitor al procesului de oxidare a radicalilor liberi:
Pentru a neutraliza acidul generat în timpul procesului de impurități, de exemplu, prin reacția:
proces de oxidare izoprpilbenzola este adesea efectuată în prezența unor agenți alcalini. Deoarece acesta din urmă este utilizat BACO 3. CaCO 3. Na2CC 3. NaHCC 2 și altele.
Descompunerea hidroperoxidului fenol și acetonă.
Descompunerea hidroperoxidului izopropilbenzenul este catalizata de acizii protonici. Reacția are loc printr-un mecanism ionic:
Se obține ca rezultat Rearanjarea cation cu migrarea grupării enol la atomul de oxigen și transformările ulterioare, rezultând în fenol și acetonă:
Oxidarea produselor secundare conținute ca impurități în hidroperoxid, de asemenea, capabil de a intra în diferite reacții, sub influența unor catalizatori acizi. Astfel, dimetilfenilcarbinolului este deshidratat pentru a forma o-metilstiren, și, de asemenea, acționează ca agent de alchilare în raport cu fenol. În plus, un metilstiren dimerizează:
S-a obținut ca o cantitate mică de rășină structură mai complexă. Odată cu creșterea concentrației de acid și de temperatură sunt posibile conversia catalitică acidă acetonă și acetofenona, de exemplu, condensarea tip aldolnoy urmată de eliminarea apei:
viteza de reacție de bază este descrisă de ecuația:
Reacția are loc foarte repede. În prezența 0,05-0,1% (în greutate). H 2 SO 4 la 50-60 0 C. aproape conversia completă se realizează după 2-3 min.
Din cauza ratei ridicate de proces când punerea sa în aplicare industrială este necesar ca valoarea sa nu se atinge limita, la care căldura nu poate fi îndepărtată pentru a face îndepărtarea proceselor controlate de căldură, reacția este efectuată în diluanți, care servesc ca produși de reacție și acetonă.
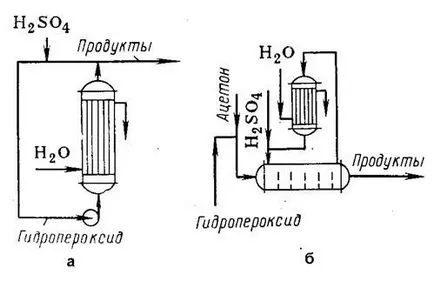
Fig. 1. Componentele de reacție pentru descompunerea acidă a hidroperoxidului:
și - un flux de sisteme de recirculare;
b - instalarea unei căldură vodom datorită vaporizării acetonă-TION.
O metodă de aplicare a reacției a fost de instalare flux de circulație (p uc. 1a), atunci când într-un reactor tubular cu RĂCIRE Denia cu apă îndepărtată termic vyde guvernare. Amestecul de reacție care părăsește reactorul este parțial retras pentru prelucrare ulterioară, dar co-lichestvo bază este reciclat: se adaugă acid catalizator și pompa este amestecat cu pornire hidroperoxi casă. Într-un astfel de sistem, timpul de contact este limitat și disiparea căldurii este umflată. În plus, recircularea amestecului conduce la un randament mai mare de substanțe secundare. Astfel, per 1 tonă de fenol obținut de 100-150 kg de deșeuri, inclusiv 15 până la 20 kg, o-metilstiren, 40-50 kg dimer și gudron, 5-10 kg acetofenona, cumilfenol și 30 kg t. D. Deși se formează oxid de mesitil nu-prea mult, dar face dificilă tratament fenol.
O altă metodă pentru descompunerea acidului hidroperoxizilor (Fig. 1b) este de a conduce reacția într-o soluție de îndepărtare de acetonă și se încălzește datorită evaporării sale. Acetona este condensat în condensatorul cu reflux și a revenit în reactor, care poate fi împărțit prin șicane transversale. Aceasta, împreună cu o scădere a concentrației de fenol în soluție și timpul de contact reduce randamentul produselor secundare.
Schema tehnologică producătoare de fenol și acetonă metoda cumen.
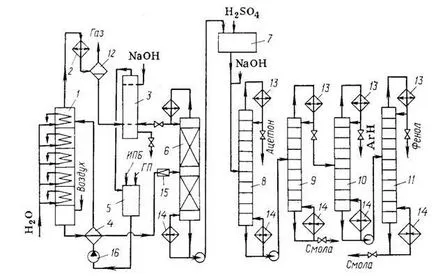
Fig. 2. Metoda Flow diagrama cumen pentru producerea de fenol și acetonă:
1 - coloana de reacție; 2 - un frigider; Z - șaibă-separator; 4 - teploob schimbător; 5 - colectare; 6, 8-11 - coloană de rectificare; 7 - asamblarea unei hidroperoxid Proposition acide ori; 12 - separator; 13 - dephlegmators; 14 - cazane; 15 - o supapă de expansiune; 16 - pompă.
fenol și acetonă producția prin etapa producătoare de cumen include izopropilbenzen, sinteza peroxid hidro-izopropilbenzen și descompunerea acidului fenol și acetonă.
Schema tehnologică a ultimelor două etape este prezentată în Fig. 2. Reacția de oxidare este condusă într-o coloană de tavă (19) prevăzută cu un frigider: a sub temperatura lor de ingrijire Hered lichid de 120 ° C la placa superioară la 105 ° C în cub. Preîncălzirea aerului purificat prin zagryaz Neny și solide și preîncălzit, este alimentat în partea inferioară a presiunii coloanei-nyuyu „0,4 MPa. Proaspăt și despre compania comandant-izopropilbenzen (SPI), la care un hidroperoxid (SE) care inițiază etapa inițială de oxidare a recipientului (5), este alimentat în schimbătorul de căldură (4) și de acolo la placa superioară a reactorului. Aerul se deplasează în contracurent cu lichidul prin barbotare prin ea pe tăvi de coloană. Astfel, uvle-pocaieste cu o pereche de izopropilbenzen și ucts volatile by-pro (acid formic, formaldehidă), care Kondo siruyutsya în frigider (2). aerul rămas este scoasă la la-mosferu, iar condensatul se spală din acid formic apos alcalin, într-un separator de scruber (3). Stratul de hidrocarburi lea a fost drenată într-o colecție (5) și stratul apos se recirculă la spălare, în cele din urmă scăzând la scurgere.
Oxida din partea inferioară a coloanei (7) conține până la 30% ghid-roperoksida. Acesta cedează căldura în schimbătorul de căldură izopropilbenzenul (4), este strangulată la o presiune reziduală „4 kPa, și se alimentează distilării în vid pentru a se concentra hidroperoxid. distilare lzopropilbenzen se efectuează într-o coloană de distilare cu umplutură (6) este continuu, prevăzut cu un condensator clorhidric-deflegmator. Aplicarea vacuum Obus-prinderea hidroperoxid instabilitate termică. O parte din izopropilbenzenul condensat este reciclată din condensator deflegmator torus-irigare a coloanei (6), iar onorurile odihnă coli la separatorul scoasă la ieșire (3), se spală cu alcalii și din nou alimentat la oxidare. Blaz lichid din coloana (6) cu susținere-70-75% din hidroperoxidul și oxidarea produselor secundare și reziduurilor izopropilbenzen. Prin distilare în vid suplimentar (nu este prezentată în diagramă) sub presiune reziduală de prefectură „665 Pa crește concentrația de gidroperok-ASDI la 88-92%. Următoarea etapă (descompunerea acidă a hidroperoxidului) se realizează la un nod (7) descrie o metode de mai sus, două sanie.
Pasul final este distilare, care se realizează într-o secvență diferită. In cele mai multe cazuri, mai întâi la presiune normală în coloana (8), acetona se îndepărtează prin distilare, apoi, sub o presiune redusă a fost separată în coloana (9) amestecul de substanțe cu punct de fierbere ridicat (rășini fenolice) rămase în cub, din produsele mai volatile, inclusiv fenol. Din această fracțiune coloana (10) a fost distilat și un resturile metilstirenul izopropilbenzenul (fracția de hidrocarburi) și în coloana (11) - fenol, lasă rășină fenolică suplimentar cubed.
La unele instalații, fracția de hidrocarburi hidro ruyut și a revenit la oxidare. Acesta previne efectul inhibitor al a-metilstiren și nu permite nici hidroperoxid centrate con la descompunere sau urmări numai „consolidarea“. O serie de metode de reciclare a rășinii fenol, inclusiv piroliză pentru a obține cantități suplimentare de fenol-TION.
la lista de articole
la lista de prelegeri