Mecanismele de reacții de substituție libere radicale
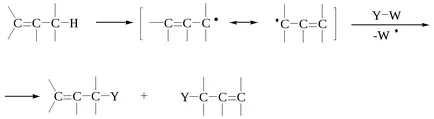
Reacția de substituție a liber R-X R-Y a primei etape trebuie să fie scindarea substratului R-X pentru a forma un radical R . care se poate face în două moduri:
în care W - inițiator.
Obazom radical R pot trece în produsul în două moduri:
În reacțiile cu majoritatea produsului lungimea medie a lanțului format prin separarea (a) și nu prin recombinare (g). tip Step rasshepleniya (a) denota SH 1, și etapa (b) și (c) stativ SH 2. Reacțiile pot fi clasificate ca SH SH 1 sau 2 pe baza faptului dacă RX R transformă în calea (a) sau o cale (b).
Reacții Mecanisme cu substraturi aromatice
În reacțiile, schema generală din care:
nu există nici un simplu sistem de separare de protoni:
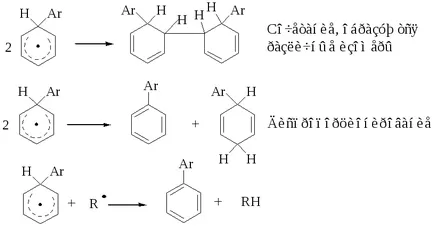
biarilii Educație descrie mecanismul implică formarea unui intermediar stabilizat rezonanță:
Intermediarul relativ stabil și reacția este terminată în trei moduri:
Participarea la grupuri adiacente reacțiilor radicalilor liberi
S-a arătat că, în unele cazuri etapa de scindare și etapa de separare sunt accelerate în prezența grupărilor învecinate. halogenarea fotolitică obicei rezultate din amestecul de produs, cu toate acestea, bromurarea lanțului de carbon având un atom de brom are loc deja cu regioselectivitate ridicată. Când bromurarea bromurilor de alchil substituția are loc în poziția vecină cu brom cu 85-95%.
Neobișnuit de mare regioselectivității este explicat în următorul mecanism prezumtivă:
De obicei Br separă radical de R-H hidrogen, dând radical R . Dacă o poziție adecvată a moleculei este deja prezent atom Br, acesta promovează procesul de separare, formând un intermediar ciclic. În etapa finală a ciclului este rupt. Dacă acest mecanism este corectă, atunci configurația atomului de carbon trebuie să fie salvat, care a fost observat de fapt. Promovarea efectului grupărilor învecinate găsite în altă substituție radicală.
Reactivitatea în substituție radicală
Etapa de reacție în lanț care determină care produsul trebuie să fie format, este adesea o etapă de separare. Sub acțiunea radical tri- sau tetravalent atomul niciodată detașat, cu excepția reacțiilor care implică sisteme intense, și rareori vine de pe un atom bivalent. De regulă, există o separare a atomului monovalent. De obicei este un proton sau un halogen. De exemplu, în reacția etanului cu un CI radical format nu atom de hidrogen și un radical etil
Principalul motiv - sterice. atom monovalent este mult mai deschis pentru a ataca radical de intrare decât un atom multivalent. Un alt motiv este acela că, în multe cazuri, atomul monovalent decalaj este mai favorabil energetic.
Alcani. Alcanii sub aproape toți radicalii în principal de pe un atom de hidrogen terțiar, apoi secundar. Gradul de preferință depinde de selectivitatea radicală și temperatura.
Efectul de selectivitate pot fi luate în considerare, de exemplu, radicalii și F Br . în poziția primară și secundară a primului raport de înlocuire este 1. 1,4, iar pentru Br mai puțin reactivă - 1. 16,000.
Natura selectivității poate varia dacă impusă de factori sterica. De exemplu, clorurarea fotochimică a izopentan în acid sulfuric sub acțiunea N-clor-di-t-butilamino și N-clor-terț-butil-terț proton primar -pentilamina separă de 1,7 ori mai rapid terțiară. În acest caz, radicalul-ion R2 + N H este suficient de mare pentru a crea o împiedicare sterică.
Olefinele. In tratamentul cu substraturi clor sau brom conținând legătură multiplă are loc, de obicei, de înlocuire și de atașament.
În cazul în care există dezlipire unui proton, aproape niciodată nu a observat separarea atomilor de hidrogen vinii, în timp ce alil protonului off mult mai ușor decât în alte părți ale moleculei. În aceste cazuri, există o rearanjare de alil.
Alchilaril. eroare apare predominant în catenă laterală -poziție în raport cu inelul. Aceeași poziție este atacată de ambii radicali activi și mai selectivi.
Compușii care conțin grupări acceptoare de electroni. Când halogenarea semnificativ atrăgători de electroni grupuri dezactiva poziția adiacentă. Astfel, compușii de tip Z-CH2-CH3 supus exclusiv sau în principal, pentru a ataca -position. Compuși cum ar fi CH3 COOH, nu vin în substituție radicală, față de electrofil, în care substituția este de preferință în poziția . Acest lucru se explică prin următorii factori. După cum se știe, particule având o pereche de electroni neîmpărtășită, au o proprietăți nucleofili, particulele având un orbital vacant de energie redus; - electrofili. Radicalii pot poseda de asemenea proprietăți nucleofilice sau electrofili în funcție de proprietățile de electroni atom care poartă electron nepereche. Halogenii sunt radicalii electrofile și poziția în căutarea cu o mare densitate de electroni. Radicalii alchil sunt, în contrast, prezintă proprietăți nucleofile și sunt capabile de abstractizare un proton din densitatea redusă de electroni.
Exemplu. Schimbare în acid propionic
indică faptul că atacurile metil mai poziții și Cl - -position.
substraturi aromatice. substituția radicalilor liberi asupra substraturilor aromatice numai rareori curge prin mecanismul de separare a hidrogenului:
De obicei format intermediar:
Efectul diferiților factori asupra reactivității substraturilor aromatice
1. Toți substituenții crește reactivitatea orto - și poziția para față de benzen, indiferent dacă acestea sunt donori de electroni sau acceptori de electroni.
2. Reactivitatea în poziția meta nu depinde de natura substituentului și este aproape de reacția capacității benzen.
3. Reactivitatea în poziția orto, în general, mai mare decât vaporii - cu excepția grupurilor foarte voluminoase.
4. În ceea ce privește grupurile electroatrăgătoare concurenței directe au un impact mai mare decât electronul.
5. Efectul de substituenți este mult mai mică decât reacțiile SN și SE.
Influenta naturii unui atacator asupra reactivității radicalului
Radicali diferă în reactivitatea lor. În acest caz, mai reactivă mai puțin selectivă, mai puțin reactiv și mai selectiv. Toți radicalii în general neutri, dar ele posedă un grad diferite proprietăți electrofile sau nucleofile.
Influenta naturii solventului asupra reactivitatii
Rasvoritel are în general un efect redus asupra reacției de substituție radical liber, opus reacțiilor ionice. Cu toate acestea, în unele cazuri, solventul poate avea un efect vizibil.
Aceste rezultate sunt atribuite formării unui complex între solvent și atomul de clor
ceea ce face CI mai puțin reactiv și, prin urmare, mai selective.