Laba apel
Biochem, 4 ani, grupa 1, 2 subgrup
munca de laborator №5.
Adsorbția la faza lichidă - gazoasă.
Determinarea tensiunii superficiale a soluțiilor. Construcția suprafeței izotermei tensiune σ = f (s). Calcularea valorilor T adsorbție la diferite concentrații. Construcția de adsorbție Izotermele T = f (s). Ecuația determinare grafică permanentă Langmuir (k și G∞) și calcularea stratului de adsorbție grosime ö și suprafața ocupată de un q moleculă.
Suprafața fazei este întotdeauna un câmp de forță sursă datorită forțelor moleculare decompensate în stratul interfaciale. Pentru a muta un singur moleculele de lichid din cea mai mare parte la suprafață este necesară pentru a face munca pentru a depăși aceste forțe îndreptate spre interior, în fază cu atracție intermoleculară mare. Prin urmare, problema noii suprafețe este întotdeauna asociată cu cheltuielile de muncă. Această lucrare identifică energia liberă în exces de pe suprafața de interfață A s raport cu energia în volum. Acest exces, menționat la unitatea de suprafață se numește energia liberă specifică și este notat cu σ (J / m2).
sisteme coloidale, ca sisteme microheterogenitate au o mare suprafață interfacială S și posedă suprafață liberă de energie semnificativă a Helmholtz
O valoare mare a sistemelor coloidale s determină instabilitatea termodinamică. Prin urmare, procesele însoțite de o scădere a -As poate aparea in sisteme coloidale. Din ecuația (1), că reducerea Deoarece poate avea loc atât prin reducerea σ, iar reducerea S. aria suprafeței de σ se datorează concentrației substanței de adsorbție în stratul de suprafață. Cantitatea T (mol / m 2) poate fi determinată printr-o cantitate în exces de substanță în stratul de suprafață, comparativ cu soluția:
unde c0 și c - concentrația în stratul de suprafață și faza în vrac; Vn - volumul stratului de suprafață.
Relația și σ r este determinat ecuația Gibbs:
unde c - concentrația solutului de echilibru, mol / l; R - constanta universală a gazelor (8.31 J / Molkov); T - temperatura absolută.
O altă modalitate de reducere a energiei de suprafață în exces A s - reducerea în zona S. Cantitatea S poate scădea datorită fenomenelor de adeziune de suprafață ale particulelor coloidale (coagulare, structurare și recristalizare). Această cale duce la moartea a dispersiei.
Din ecuația (3) rezultă că determinarea cantității de adsorbție este redusă la studiul experimental al dependenței de specific sigma energia de suprafață a concentrației substanței în faza vrac: σ = f (s). Valoarea este numita activitate de suprafață. Acesta descrie capacitatea unei substanțe de a schimba energia de suprafață specifică. Substanțe reducătoare σ, numite substanțe active de suprafață (surfactanți); pentru a le g> 0, deci T> 0 (adsorbție pozitivă). Prin agenți activi de suprafață sunt alcooli, acizi organici, esteri, săpunuri, etc. Cu privire la fond, care reduc energia de suprafață sunt cunoscute sub denumirea de suprafață inactivă (Pina); pentru ei g<0 и Г<0 (отрицательная адсорбция). К ПИНАВ относятся растворы сильных электролитов.
adsorbtie pozitivă joacă un rol foarte important în procesele naturale și industriale. Este una dintre etapele de procese catalitice eterogene din industria chimică, prin care primesc în prezent mai mult de 70% din produse chimice. Având în vedere importanța deosebită a absorbției pozitive, de multe ori sub adsorbție înțeleg de adsorbție exact pozitiv. Dependența de energie de suprafață specifică sau tensiune superficială a lichidelor pure de temperatură este descrisă de ecuația fundamentală a fenomenelor de suprafață termodinamicii - ecuația Gibbs:
unde S s - un exces de entropie în stratul de suprafață; Ipsos Gi și σi - adsorbție și potențialul chimic al componentei i-lea.
Dacă n = 1 (sistem lichid-vapori), apoi
Numeroase studii au arătat că S e este constantă până la temperatura critică. Prin urmare, dependența liniară σ T (ecuația Eötvös):
în care Ts - temperatură apropiată de critică.
Punctul critic este tensiunea de suprafață, așa cum se arată în Mendeleev 1860 g. Dispare. Alături de ea se duce la zero și excesul de entropie în stratul de suprafață. Tensiunea superficială a apei pure cu temperatura, dacă temperatura este departe de critică, exprimată prin ecuația:
în care - tensiunea superficială (J / m 2) de apă, la temperatura T.
Existența energiei libere în exces de pe suprafața curbată conduce la așa-numitele fenomene capilare. Presiunea în cele două faze în vrac, separate printr-o suprafață curbă, sunt diferite. Diferența dintre aceste presiuni, desemnate se numește presiune Ap capilară. În echilibrul afirmă presiunea capilară datorită tensiunii superficiale la interfața fazei σ și caracteristicile sale geometrice (razele principale de curbură R1 și R2 al elipsei) ecuația derivată din Laplace 1,805 g .:
Aceasta se aplică în cazul în care curbura razei de interfață este mare în comparație cu raza forțelor intermoleculare. Pentru o suprafață sferică de R1 = R2 = R și ecuația Laplace devine următoarea formulă:
ecuația lui Laplace poate fi utilizată pentru a determina tensiunea superficială a fluidului la interfața cu gazul sau alt lichid nemiscibil-l. Determinarea Metoda bazată pe măsurarea presiunii maxime necesare pentru forțarea bulei de gaz printr-un tub capilar cufundat în lichidul de testare (figura 1).
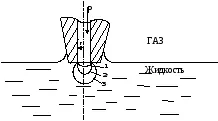
Din figura 1 se observă că mai întâi scade raza cu bule (poziția 1-2) la R = r. apoi crește (poziția 2-3). Aceasta este, prin creșterea presiunii în schimbare raza bulei trece printr-un minim. Conform ecuației lui Laplace schimbare R trebuie să aibă loc printr-un maximum la R = r. Cand presiunea maxima bula de gaz Pmax devine instabil și rapid separat de capilar. lichid tensiune Comunicare suprafață cu un gaz și un lichid cu o ecuație Pmax Cantor densitate este dată:
Ecuația (10) se aplică atunci când r <1мм. Для очень тонких капилляров, когда r ≈ 0,1 мм, уравнение (10) упрощается:
Pentru cele două lichide, cu o tensiune de suprafață și σ ecuația“(11) devine:
unde - presiunea maximă necesară pentru formarea unei bule în lichid, respectiv 1 și fluid 2. Din ecuațiile (12):
Ecuația (13) permite calculul tensiunii de suprafață a fluidului necunoscut (σ „), cunoscând maximă a presiunii P“ max pentru acest lichid și pentru lichid standard, Rmax cu tensiune superficială cunoscută (de exemplu apă).
Izoterma de adsorbție la interfața dintre fazele lichidă și gazoasă.
Ecuația (3) Gibbs este una dintre ecuațiile fundamentale ale chimiei coloidale, care are loc pentru orice limită de fază. Utilizarea pe scară largă a acestei ecuații pentru studiile de adsorbție pe suprafața lichidului cu gaz (sau vapori), datorită determinării relativ ușoară a lichidelor sigma. Pentru metode directe solide sigma nici o dimensiune.
După ce a determinat experimental din relația σ s - tensiune superficială izoterma, și folosind ecuația Gibbs, putem găsi valoarea de adsorbție la concentrații diferite, adică, adsorbție izotermă.
Determinarea metodei grafice G a ecuației Gibbs.
Pe tensiune superficială numărul izotermă ales de puncte, care se realizează și linia tangentă paralelă cu abscisa. Deoarece tangenta este derivată, și de construcție văzut chtotg = - tg =, atunci subiectul ecuația Gibbs (3) obținem:
Un grafic al adsorbției izotermei T = f (c)
Dependența valorii de adsorbție este descrisă de ecuația Langmuir:
în care G - limitarea adsorbției sau valoarea de adsorbție la full adsorbtiv saturație suprafață monostrat; k - constanta de echilibru de adsorbție.
Determinarea caracteristicilor stratului de suprafață.
Valorile constante ale ecuației Langmuir G și k sunt metoda grafică. Ecuația (15) este convertit într-o formă liniară:
Complotat c / r de la c.
Din ecuația (16) implică faptul că fie
Valoarea G poate fi găsit prin utilizarea ecuației empirice Shishkovsky:
unde 0 - tensiunea superficială a fluidului pur A și B - permanent.
Ecuația permanentă (19) este conectat cu relația G:
Pentru valori cunoscute 1 și B în conformitate cu ecuația (19) putem calcula ecuația constantă A Shishkovsky și asigurați-vă că A este egal cu o ecuație Langmuir constantă k.
Calcul și q.
Stabilirea de formule de calcul a înălțimii stratului de adsorbție și suprafața ocupată de o moleculă de suprafață pe suprafața q soluție (vezi. Figura 2).
Fig.2. Dispunerea circuitului a moleculelor de agent tensioactiv din suprafața stratului de grosime .
La stratul de adsorbție de saturație a moleculelor de agent tensioactiv sunt așezate vertical, în care grupările polare sunt în soluție, un grup non-polar de atomi (radicali) - în aer. Pe zona de S = 1 m 2 de suprafață sunt G surfactant mol / m 2 sau G M în kg / m 2, unde M - masa molară a substanței (kg). Pe de altă parte, în ecran este S S kg de material unde - densitatea substanței în kg / m3 sau în kg / m 2. Apoi G M = sau
Numărul de molecule de surfactant per 1 m 2 este G NA. în cazul în care NA - numărul lui Avogadro. În consecință, suprafața ocupată de o singură moleculă este:
Comparând valoarea calculată a grosimii stratului de moleculă lung cunoscută a structurii sale, este posibil să se concluzioneze că orientarea moleculelor de agent tensioactiv în stratul de adsorbție.
Ordinea de performanță:
Determinarea tensiunii superficiale a soluțiilor de agent tensioactiv se realizează prin presiunea cea mai mare de bule de gaz. această metodă de lucru se realizează într-un aparat construit P. A. Rebinderom (Figura 3).
Receptacul (1) lichidul de testare (20-50ml) este conectat la un manometru de apă (2) și o pâlnie de picurare (3), care servește pentru a crea un vid mic în sistem. Vasul (4) este utilizat ca rezervor tampon. Sistemul de vid este furnizat de scurgere lentă de apă din pâlnie de separare (3) într-un pahar de laborator. Vasul a fost închis etanș cu un dop de cauciuc prin care un tub de sticlă (5), care se încheie într-un capilar.
Vârful capilar trebuie să aibă margini ascuțite netede. sfaturi foarte convenabile din sticlă groasă, cu extensia pipetkoobraznym precedent capilar.
Purificare vârful de aspirație capilară se face un amestec în acesta cromic cu un ventilator, urmată de spălare cu apă distilată. In capilar experiment vârful scufundat în lichid, dar astfel încât acesta a atins doar suprafața, ușor ridicarea lichidului (Fig.3.).
Experiența începe prin definirea Pmax pentru apă distilată. 6. Deschideți supapa din interiorul vasului 1 și vidul creat prin aer lichid bule începe să alunece. cu bule de viteză formarea supapă de reglare 6, astfel încât formarea a fost de cel puțin 10-20 de secunde. pe suprafața bulei poate fi stabilită de adsorbție de echilibru în acest timp. La determinarea tensiunii superficiale la frontiera lichidului care conține agentul tensioactiv, este necesar ca timpul formării bulelor nu a fost mai mică de 30 de secunde. Când bulele Suprasolicitării observați diferența de indicator de nivel de lichid (2). Diferența de nivel de lichid în gabaritul bH = -h1 h2. unde h2 - indicator de nivel de lichid în genunchiul stâng; h1 - la dreapta corespunde presiunii maxime necesare pentru formarea bulei Pmax. Schimbați poziția supapei 6 și se repetă de măsurare Pmax 3-4 ori și să ia valoarea medie a bH (fluctuații observații individuale nu trebuie să depășească 1-2 mm).
In mod similar vom efectua măsurarea soluție bH surfactant pentru 5-6 concentrații diferite. Tensiunea superficială a soluției calculată prin ecuația (13). Tensiunea superficială a apei în funcție de temperatura calculată prin ecuația (7). Datele experimentale și calculate este înscris în tabelul 1.
Conform tabelului de a construi 2 adsorbție Izoterma T = f (a) și un grafic al C / T = f (s). Conform ecuațiile (17) și (18) sunt valori ale constantelor ecuației Langmuir G∞ și k calculate.
CTG G∞ = α = 0.49 / 0.49 * May 10 = 1 * 10 -5 mol / m 2
k = 1 / a * G∞ = 1 / 1,2 * 10 5 * 1 * 10 -5 = 0,83 mol / l
Adsorbția izotermei T = f (s).

Grafic c / T = f (s).
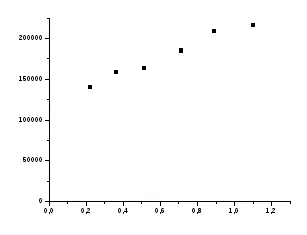
În izotermei de adsorbție selectați un număr de puncte 5 și determină valoarea B din ecuația Shishkovsky (21). G∞ se așteaptă de la ecuația (20) și compară această valoare cu valoarea de G∞. calculat conform ecuației Langmuir.
B1 = (0.073-0.065) / ln (1.26 / 0.51-1) = 0,021 J / m 2
B2 = (0.073-.067) / ln (0,9 / 0,4 - 1) = 0,027 J / m 2
BSR = (0,021 + 0,027) / 2 = 0,024 J / m 2
G∞ = 0,024 / 8,314 * 291 = 9,9 * 10 -6
Valoarea calculată este aproape egală cu G∞ G∞. Langmuir Calculat:
Conform ecuației (19), numărând o constantă în ecuația Shishkovsky și asigurați-vă că A = k în ecuația Langmuir.
0.073-0.060 = 0.024 ln (1 + 0,869 * A)
ln (1 + A * 0,217) = 0,54
0,54 f = 1 + A * 0,869
Calculată o constantă este aproape în valoare k, calculată prin ecuația Langmuir:
Conform ecuațiile (22) și (23) înălțime δ față a stratului de adsorbție și suprafața ocupată de o moleculă de surfactant.
Concluzie: În tensiunea superficială a soluțiilor de lucru în laborator etanol de diferite concentrații a fost determinată. Izoterma construit σ = f (c). Valoarea a fost calculată adsorbție izotermei de adsorbție G. construită F = f (s). Această relație satisface ecuația Gibbs pentru astfel de sisteme, deoarece dependența C / T = f (c) are un caracter liniar. Grăitor, valorile constantelor: adsorbție la echilibru constant (K), iar la adsorbție de saturație plin de suprafață un strat monomolecular de adsorbant (G∞). Valori primite: înălțimea stratului de adsorbție și zona q δ, 1 ocupat de molecula de surfactant la suprafața soluției.
k = 0,83 mol / l G∞ = 1 * 10'5 mol / m2 δ = 5,77 * 10-4 m q = 1,68 * 10-19 m2