Eseu „producția de CFC-uri,“ platforma de conținut
1. Prezentare generală a procesului de halogenare 4
2. Siguranța în halogenarea procesează 9
3. Produsele chimice și bazele teoretice ale procesului de obținere a Freon 10
4. Tehnologia procesului de obținere a Freon 11
Bibliografie 14
Fabricarea organicele a apărut foarte mult timp, dar inițial sa bazat pe prelucrarea materiilor prime vegetale sau animale - (. Săpun, alcool și altele) selectarea materialelor (zahar, ulei) sau separarea. Organic Synthesis, t. E. Prepararea substanțelor mai complexe ale unui relativ simplu, își are originea în produsul secundar pe bază de la mijlocul secolului XIX cărbune cocsificabil conținând compus aromatic. Apoi, deja în secolul XX ca o sursă de materii prime organice devin din ce în ce rol important de jucat de petrol și gaze naturale, minerit, transport și prelucrare, care sunt mai economice decât cărbunele. Aceste trei tipuri de materii prime fosili se bazează în principal industria și sinteze organice. In procesele de separare fizică, sau scindare catalitică termică (cocsificare, cracare, piroliză, reformare, conversie) obținute cinci grupe de materii prime pentru sinteza multor mii de alți compuși:
1. Parafinele (CH4 din metan la hidrocarburi C15 - C40);
2. Olefinele (C2H4, C3H6, C4H8, S5N10);
3. Hidrocarburi aromatice (benzen, toluen, xilen, naftalină);
5. monoxid de carbon și gazul de sinteză (un amestec de CO și H2).
In dezvoltarea industriei sintezei organice a fost împărțită în mai multe sectoare (tehnologia dye, medicamente, materiale plastice, fibre etc.), printre care o industrie importanta loc sinteza organica si petrochimice de bază. Termenul „majore“ (sau „hard“) se referă la producerea sintezei organice mnogotonazhnyh produse care furnizează baza pentru restul tehnologiei ecologice. La rândul său, termenul „Petrochemical“ sinteza a apărut în legătură cu tehnologia de transformare a materiei organice a materiilor prime petroliere în sensul obișnuit al cuvântului (excluzând prepararea substanțelor anorganice și polimeri) se referă la rafinare chimică din petrol hidrocarburile primare derivate. În acest sens, este o parte a sintezei organice, iar acest lucru se datoreaza varfurilor lor combinate.
1. Prezentare generală a procesului de halogenare
1. Halogen preparat în trei moduri principale: în-deplasări, montarea și divizare.
Schimbare (substitutivă) halogenarea este substituția cu atomi de halogen alți atomi sau grupe. Dintre acestea cel mai important este substituirea atomilor de hidrogen
RH + CI2 → RCI + HCI
care pot să apară cu ambii atomi de carbon saturați și nesaturați sau un nucleu aromatic. Capacitatea de a-scheniyu înlocuit este stocat în diverși derivați de hidrocarburi.
Substituirea unui atom de halogen pe altul este importantă pentru obținerea de fluor, brom - și yodoproizvodnyh compușilor organoclorurati mai sunt disponibile:
CCI4 + 2HF → CCI2F2 + 2HCI
RCI + NaBr → RBr + NaCl
Înlocuirea OH - grupa cu un atom de halogen este utilizat pentru a produce unele dintre halogen și acide cloruri:
ROH + HCI → RCI + H2O
RCOOH + COCI2 → RCOCI + CO2 + HCI
Conectarea (aditiv) halogenare - îmbinare agenți de halogenare la compuși nesaturați are la fel de mare importanță practică, deoarece substituția. halogeni liberi sunt capabili să se alăture la C = C S≡S și Sar-Sar:
CH2 = CH2 + CI2 → CICH2-CH2CI
CH≡CH + 2CI2 → CHCI2-CHCI2
C6H6 + 3CI2 → C6H6CI6
Halogenuri sunt atașate la legăturile duble și triple (gidrogalogenirovanie) și olefinele reacționează de asemenea hlorgidrirovaniya:
CH2 = CH2 + HCI → CH3-CH2CI
CH≡CH + HCI → CH2 = CHCI
CH2 = CH2 + CI2 + H2O → CH2CI-CH2OH + HCI
Capacitatea unui aditiv la reacțiile de halogenare de mai sus a salvat mulți derivați ai hidrocarburilor nesaturate.
Un caz special este clorurarea aditiv de atașare a atomilor de clor în stare de valență inferioară, de exemplu, sinteza fosgen de monoxid de carbon și clor:
CO + CI2 → COCI2
Reacțiile de scindare clorurate devin tot mai importante. Dintre acestea apare mai ușor dehidroclorurare (1), revers HCI plus. Din cauza preferinței acestei reacții alte procese de scindare sunt observate numai la temperatură ridicată în perhlorproizvodnyh. Acest - diclorurării (2), inversa conexiunea CI2 și scindarea legăturilor carbon-carbon, care poate avea loc sub acțiunea clorului - chlorolysis (3) sau hlorinoliz sau la temperatură ridicată - piroliză (4):
CH2CI-CH2CI = CH2 + HCI CHCI
CCI3-CCI3 CCI2 = CCI2 + CI2
CCI3-CCI3 + CI2 2CCI4
CCI3-CCI2-CCI3 CCI4 + CCI2 = CCI2
2. Reacții de halogenare Termodinamică
Reacțiile de halogenare sunt foarte diferite caracteristici de putere, care determină caracteristicile lor semnificative. Mai jos reacțiile comparate efectele termice care cuprind fluor, clor, brom și iod pentru un ideal substanțe de stat gaz:
După cum se vede din datele de mai sus, efectul termic este redus în rândul F2> CI2> Br2> I2, care ocupă un loc special reacția fluorurare și iodurare. Mai întâi însoțite de căldură foarte mare mai mare decât diferența de energie a C-C și C-H. Dacă nu luați măsuri speciale, acest lucru va duce la o descompunere profundă a materiei organice. Pe de altă parte, iodarea continuă efectul termic foarte mic sau chiar negativă și, în contrast cu reacțiile cu fluor, clor și brom, este reversibil. Aceasta, împreună cu activitatea scăzută de iod deoarece cauzele reactante primesc yodoproizvodnye alte moduri. Cu toate acestea, ele sunt produse la scară mică și nu fac parte produsele ale sintezei organice și petrochimice de bază.
Efectele termice ale unor reacții care implică halogenuri de hidrogen într-un substanțe gazoase ideale sunt după cum urmează:
C2H4 + HF → C2H5F ()
+ HCI C2H4 → C2H5CI ()
C2H4 + HBr → C2H5Br ()
C2H4 + HI → C2H5I ()
Toate aceste reacții sunt exoterme și halogenuri pentru diferența este mai mică decât halogeni liberi. Este important ca toate reacțiile care implică halogenhidrici sunt reversibile.
3. Agenți de halogenare
Cea mai mare valoare ca agenți de halogenare sunt halogenuri de hidrogen fără halogen și anhidre. Punctele lor de fierbere la presiune atmosferică sunt prezentate în Tabelul 1.
Punctul de fierbere al halogenhidrici și halogeni la presiune atmosferică
Toate acestea sunt solubile în lichide organice (Br2> CI2> F2 și HBr> HCl> HF), care este foarte important pentru procesul de halogenare în fază lichidă. Au un miros înțepător, irita membranele mucoase ale ochilor și a tractului respirator, și halogeni liberi posedă un efect în plus sufocant. fluor deosebit de periculos și acid fluorhidric pielii corodează capabil și oase.
Clorul este produs prin electroliza soluțiilor apoase de clorură de sodiu (saramuri) sunt formate simultan când hidrogenul și electrolitic alcalin:
Na + HO- → NaOH
Clorul gazos rezultat care are o concentrație de 92% ≈ CI2 și conține impurități N2, O2 și CO. Ele pot fi separate prin lichefierea clorul, care evaporarea da produsul pur sunt adesea mai preferate pentru procesele de clorurare.
Acidul clorhidric este obținută cu temperatură ridicată de sinteză din hidrogen și clor:
H2 + CI2 → 2HCI
Fluorul produs prin electroliza topit biflorură KHF2 de potasiu și acid fluorhidric anhidru - acțiunea acidului sulfuric asupra fluorină:
CaF2 + H2SO4 → CaSO4 + 2HF
Toți agenții halogenarea agresivi față de materialul echipamentului, iar efectul lor coroziv este crescută în special în prezența chiar urme de umiditate. Prin urmare, în procesele pentru fluorurarea echipamente de fabricare a cuprului folosit sau nichel, iar clorurarea și bromurare protejează oțelului emailurile corpului, plumb sau materiale ceramice, de asemenea, folosind tipuri speciale de oțel, grafit și biciuit pentru conducte - plumb. Pentru a reduce coroziunea atât halogenare și reactivii organici trebuie să fie supuse la deshidratare.
2. Siguranța în procesele de halogenare
Pe lângă problemele generale legate de explozivitate și toxicitate a materiilor prime (hidrocarburi, monoxid de carbon), halogenarea are loc la o serie de condiții specifice de siguranță.
Nu numai agenți de halogenare, dar, de asemenea, pentru a obține derivații halo adesea au crescut de toxicitate. Ele afectează sistemul nervos central, au un efect de umezire sau narcotice (cloroform, cloralhidrat), irita membranele mucoase ale ochilor și ale tractului respirator (benzil, cloracetonă) și fosgen are un efect sufocant. Ca urmare, în halogenarea sunt cerințele pentru magazine de etanșeitate și de ventilare a crescut. La locul de muncă sunt necesare primele echipamente de ajutor și de gaz măști.
halogeni liberi, cum ar fi oxigenul și aerul, poate produce o hidrocarbură și monoxid de carbon amestecuri explozive. Procesul de ardere într-o atmosferă de halogen foarte exotermic și la anumite concentrații trece la explozie. Superioară și inferioară limitelor pentru amestecuri explozive de parafine inferioare și olefine cu clor se află în intervalul de la 5 la 60% (vol.) Hydrocarbon. Acest lucru face necesară luarea unor măsuri speciale de siguranță atunci când amestecarea hidrocarburii cu halogeni, în special în reacțiile de gaz cu temperatură ridicată. Dar aceste producții exploziv este amplificată de faptul că multe halogenate da un amestec exploziv cu aerul. Astfel, limitele de explozie ale amestecurilor cu aer în sus (vol.):
CH3CI - 19,0 ÷ 7,6
C2H5CI - 3,8 ÷ 15,4
C2H4CI2 - 16,0 ÷ 6,2
Prin creșterea numărului de atomi de halogen în molecula exploziei compus este redus, chiar și tetraclorură de metan utilizate pentru stingerea incendiilor.
3. fundații Chimia și teoretice ale procesului de obținere a CFCs
Freoni sau Freone Chemat ftorhlorproizvodnye metan și etan. Acesta - substanțe gazoase sau lichide cu emisii reduse de fierbere cu miros slab, foarte puțin toxic și complet non-inflamabil. Astfel de proprietăți au asigurat utilizarea lor pe scară largă ca agenți de refrigerare în mașini frigorifice. O aplicație importantă a CFC spray cu aerosol este unele substanțe. Freoni sunt de asemenea intermediari în producerea de fluoroolefins.
Pentru freonilor instalate numele abreviate corespunzătoare compoziției lor chimice, - .. freon-12, Freon-114, etc. Ultima cifră indică numărul de atomi de fluor, a doua cifră, a doua cifră din dreapta este unul mai mare decât numărul de atomi de hidrogen, iar primul stânga - pe unitate mai mic decât numărul de atomi de carbon în moleculă. Astfel, în freon-12 are doi atomi de fluor, și nici hidrogen este un atom de carbon, care dă formula CCI2F2. Freon-113 este derivat din formula etan și C2CI3F3 t. D.
freonilor majore sunt produse industrial prin substituirea atomilor de clor de fluor în cloroform, tetraclormetan, tetra-, penta - și hexacloretan, și cloroform. Mai jos sunt numele unor freoni și punctul lor de fierbere (sau condensare) la presiune atmosferică:
→ CHCI2F → CHCI3 → CHCIF2 CHF3
Cea mai mare valoare din domeniu au freon-12, freon-22 și Freon-113. Când se răcește adânc folosind fierberea freon-13 și Freon 23.
4. Tehnologia procesului de obținere a freonului
Ca un exemplu tipic analizează producția de difluordiclormetan - freon-12 din tetraclorură de carbon și acid fluorhidric anhidru, în prezența halogenuri de antimoniu. Reacția este efectuată la 1000C și 3 MPa; la această presiune CCI4, CCI3F și HF sunt lichide și se pot CCI2F2 distilă este format, împiedicând astfel obținerea unor cantități semnificative CCIF3.
Schema tehnologică a producției de CFC-12 este prezentată în Fig. 1. tetraclorură de carbon și acid fluorhidric lichid furnizat de pompele 1 și 2 sub presiune într-un reactor 3, în care catalizatorul lichid (amestec de cloruri și fluoruri trei - și antimoniu pentavalent, se diluează amestecul de alimentare reactant și nedoftorirovannym produs). A fost alimentată intermitent la acesta, în porțiuni mici clor.
Reactorul constă dintr-un oțel cu un aparat de acoperire anticorozivă, echipat cu o manta de abur, o coloană de reflux ambalat, un condensator de reflux 4 și 5. HCI rezultat poartă cu vapori de substanțe organice și acid fluorhidric. În coloana 4 se produce vapori de reflux, și tetraclorură de carbon și monofluortriclormetanul revenit în reactor. Pentru a crea o porțiune de reflux a vaporilor este condensat în condensatorul 5 difluordiclormetan și a revenit la reflux coloana 4.
amestec de gaz de vapori care părăsește condensatorul 5 conține în principal acid clorhidric și diclorodifluorometanului cu momnoftortrihlormetana amestec, monohlortriftormetana și acid fluorhidric. După reducerea presiunii la aproape atmosferică în valva de expansiune 6 HF este separată în bucăți ambalate fluorura de potasiu turn 7. Acesta din urmă reacționează cu HF, formând KHF2, care poate fi utilizat pentru prepararea fluorului prin electroliza. Diagrama arată cea mai simplă purificare prin absorbția apei în exces din scruber 8 și alcaliilor apos într-un scruber 9. Deshidratarea restului de gaz poate fi efectuată cu acid sulfuric concentrat care circulă în coloana 10.
Pentru separarea ftorhlorproizvodnyh utiliza rectificare la temperatură scăzută. Cuplurile comprimat de către compresorul 13 la o presiune de 1,0-1,2 MPa și o saramură răcită în frigider 11 la minus 10 - 150C minus. Condensul rezultat este trimis la unitatea de separare, constând din mai multe coloane de distilare.
Fracțiunea ușoară cuprinde monohlortriftormetana (cu un difluordiclormetan amestec mic), care este un produs secundar de producție. reziduuri grele de după distilare conține monofluortriclormetanul a revenit în reactor. Fracțiunea țintă de freon-12 este obținut sub forma unui lichid sub presiune. Pentru utilizare ca agent frigorific este necesară în continuare pentru dezumidificarea - tratament prin înghețare umiditate sau adsorbanți solide, cum ar fi zeoliții.
Recent, pentru freonii dezvoltat și introdus în industria gazului de sinteză a CCI4 și HF în stratul psevdoozhennom unui catalizator eterogen bazat pe antimoniu la 4000C. La fel ca procesele de clorurare combinate se propune combinarea clorurarea hidrocarburilor (CH4, C2H6), substituția cu clor cu ajutorul HF. Reacția este condusă prin ajustarea temperaturii prin reciclarea derivaților insuficient fluorurate și clorurate neconvertit.
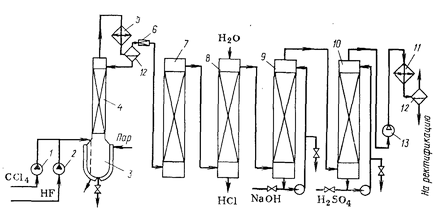
Fig. Schema tehnologică 1 freon-12
1.2. Pompe, Reactor 3., 4. coloană de reflux 5. capacitor Revers 6. Supapa de accelerație. 7. Turnul de curățare, 8, 9. Spălătorul 10. Coloana de scurgere 11. Frigider 12. Separator 13. Compresor
2. Chichibabin începutul chimiei organice. Goskhimizdat M., 1963. - 922 p.;
3. Lebedev și Tehnologia sintezei organice și petrochimice de bază. M. Chimie. 1988. - 592 p;.
4. Sinteza petrochimic Vishnjakova. M., 1973. - 448 p.;
5. Yukelson sinteze organice de bază. M. "Chimia" 1968.