Efectul catalizatorului asupra vitezei reacțiilor chimice
Substanțele care sunt implicate în reacțiile și crește viteza, rămânând neschimbată până la sfârșitul reacției, numite catalizatori.
Fenomenul de schimbare a vitezei de reacție sub acțiunea acestor substanțe numite catalizei. Reacțiile sub influența catalizatorilor sunt denumiți catalitică.
In cele mai multe cazuri, efectul catalizator se explică prin faptul că acesta scade energia de activare a reacției. În prezența kata-recuperatoare reacția trece prin etape intermediare, altele decât cele fără, acești pași disponibile energetic. Cu alte cuvinte, în prezența unui catalizator cu alte complexe activate, iar formarea lor necesită mai puțină energie decât pentru formarea complexelor activate apar fără catalizator. Astfel, energia de activare scade brusc: unele molecule a căror energie a fost insuficientă pentru coliziune activă acum sunt active.
Pentru o serie de reacții intermediare studiate; De regulă, ele reprezintă un produse instabile foarte activi.
Mecanismul catalizatorilor este asociat cu scaderea energiei de activare datorită formării intermediarilor. Cataliza poate fi reprezentat după cum urmează:
unde A. K - activat compus intermediar.
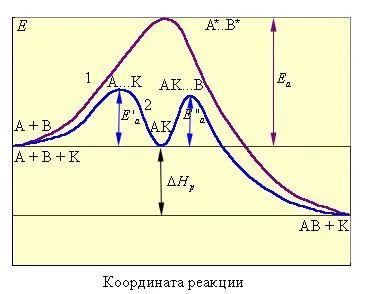
Figura 13.5 - calea Image reacție necatalitic O reacție + B → AB (curba 1) și o reacție catalitică omogenă (curba 2).
În industria chimică catalizatori din industrie sunt utilizate pe scară foarte largă. Sub influența catalizatorilor de reacție pot exprima check-ryatsya un milion de ori sau mai mult. În unele cazuri, sub influența catalizatorilor pot fi excitate astfel de reacții care au loc fără ele, practic, în aceste condiții.
Distinge între cataliza omogenă și heterogenă.
In cazul catalizei omogene, catalizatorul și reactanții formează o singură fază (gaz sau soluție). În cazul catalizei eterogene, catalizatorul este în sistem ca o fază independentă.
Exemple de cataliză omogenă:
1) oxidarea SO2 + 1 / 2O2 = SO3 în prezența NO; NO este oxidat la NO2. și NO2 oxideaza deja SO2;
2) descompunerea peroxidului de hidrogen în soluție apoasă în apă și oxigen: O 2 ioni Cr2 = 7. WO 2- 4. MoO 4 2- catalizează descompunerea peroxidului de hidrogen, intermediari formă cu acestea, care se descompun în continuare cu degajare de oxigen.
cataliză Omogen se realizează prin reacția intermediarului cu catalizatorul, iar rezultatul este un înlocuitor al unei reacții cu o energie ridicată de activare de mai multe, în care rata de energie de activare inferioară de mai sus:
CO + 1 / 2O2 = CO2 (catalizator - vapori de apă).
Utilizate pe scară largă în industria chimică este cataliza heterogenă. Cele mai multe dintre produsele fabricate în prezent această industrie este obținut prin cataliză heterogenă. În reacția cataliza heterogenă se produce pe suprafața catalizatorului. Rezultă că activitatea catalizatorului depinde de mărimea și proprietățile suprafeței sale. Pentru a avea o ( „dezvoltată“) de suprafață mare, catalizatorul trebuie să aibă o structură a porilor sau să fie în stare foarte fragmentat (înalt dispersat). În practică, catalizatorul este aplicat în mod obișnuit la un purtător având o structură poroasă (piatră ponce, azbest etc.).
Ca și în cazul catalizei omogene, reacția cataliză heterogenă are loc prin intermediari activi. Dar aici, acești compuși reprezintă compuși cu suprafața reactanți catalizatorului. Trecând printr-o serie de etape care implică acești intermediari, reacția se termină cu formarea produselor finale, iar catalizatorul rezultat nu este consumat.
Toate reacțiile catalitice heterogene includ etapa de adsorbție și desorbție.
Acțiunea catalitică a suprafeței este redusă la doi factori: creșterea concentrației la interfață și activarea moleculelor adsorbite.
Exemple de cataliza heterogenă:
Un rol foarte important joacă cataliza în sistemele biologice. Cele mai multe reacții chimice în sistemul digestiv, sânge și în animale și celule umane, sunt de reacție catalitică. Catalizatorii menționate în acest caz, enzime reprezintă proteine simple sau complicate-WIDE. De exemplu, saliva conține enzima ptialina care catalizează conversia amidonului la zahăr. O enzimă prezentă în stomac - pepsina - catalizează scindarea proteinelor. Corpul uman este de aproximativ 30 000 de enzime diferite, fiecare dintre care servește ca un catalizator eficient pentru o reacție.
Selectivitatea acțiunii catalizatorului este acela că produsele de reacție pot fi diferite în funcție de modul în care catalizatorul folosim.
Foarte lent fluxul de procese chimice nedorite, în multe cazuri, este posibil, prin adăugarea de inhibitori în mediul de reacție (fenomenul de „cataliză negativă“).
Pagina generata pentru: 0,005 sec.