disocierea apei
Apa pura este conductor foarte slab de curent electric, dar are încă o conductivitate electrică măsurabilă, care se explică prin disociere parțială a moleculelor H2 O în ioni de hidrogen și ioni de hidroxid:
Amploarea conductivitatea electrică a apei pure poate fi calculată concentrația de j ioni H + și OH -. La 25 ° C, este egal cu 10 -7 mol / l.
Constanta de disociere a H2 O se calculează după cum urmează:
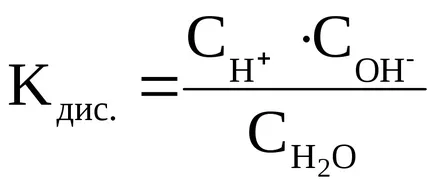
Noi rescrie această ecuație:
Trebuie subliniat faptul că această formulă constă din concentrațiile de echilibru ale moleculelor H2 O, ionii H + și OH -. sunt stabilite în momentul echilibrului în disocierea H2 O.
Dar, deoarece gradul de disociere de H2O este foarte mic, se poate presupune că concentrația moleculelor nedisociat de H2O în momentul de echilibru este practic egală cu concentrația totală de apă inițială, adică 55.56 mol / dm 3 (1 dm 3 H2O conține 1000 g de H2O sau 18, 1000. ≈ 55,56 (mol). Se poate presupune că concentrația de N2 O vor fi aceleași în soluții apoase diluate. De aceea, înlocuind în ecuația (42) produsul a două constante

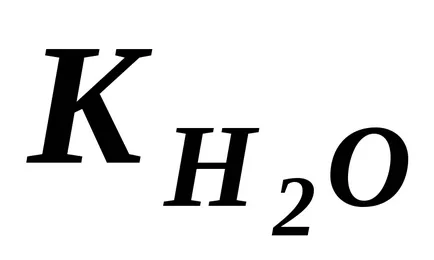
Ecuația rezultată arată că pentru apă și soluțiile apoase diluate la o temperatură constantă, produsul a concentrațiilor molare de ioni de hidrogen și ioni de hidroxid este constantă. Se numește diferit produs ionic al apei.
In apa pura la 25 ° C. Prin urmare, temperatura indicată:
Prin creșterea valorii temperaturii
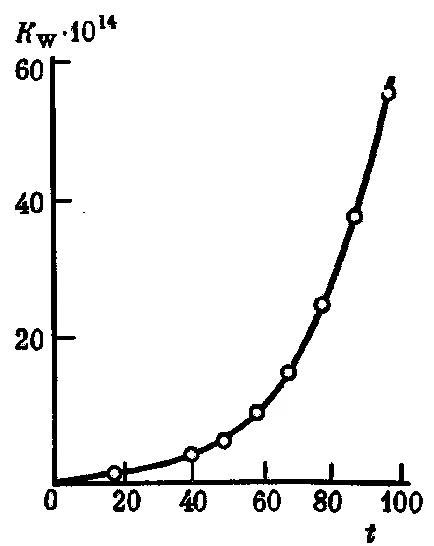
Fig. 34. Dependența de disociere a apei Kw constantă a temperaturyt (° C)
Soluțiile în care concentrația de ioni H + și soluții nazyvayutsyaneytralnymi OH identice. Vkislyhrastvorah mai conține ioni de hidrogen și ioni de hidroxid vschelochnyh-. Dar, indiferent de mediul de reacție în soluție, produsul concentrațiilor molare de H + și OH - rămâne constantă.
Dacă, de exemplu, pentru a curăța H2O adăuga o anumită cantitate de acid și concentrația de ioni H + va crește apoi la 10 -4 mol / dm 3 concentrație OH - ionii scade, respectiv, astfel încât produsul de

În practică, pentru caracteristicile cantitative ale aciditate sau alcalinitate a soluției nu este utilizată în ea concentrația molară de ioni H +. și logaritm negativ. Acest indice valoare nazyvaetsyavodorodnym și notat cherezrN:
De exemplu, dacă pH = 2; dacă pH = 10. pH neutru soluție = 7. în soluții de pH acide <7 (и тем меньше, чем «кислее» раствор, т.е. чем больше в нём концентрация ионов Н + ). В щёлочных растворах рН> 7 (cu cât soluția și „alcalină“, adică mai puțin decât în ea concentrația de ioni H +).
Există diferite metode de măsurare a pH-ului soluției. Foarte convenabil soluția de reacție aproximativ evaluată prin intermediul unor reactivi speciali numite indicatori acido-bazic. Acoperirea acestor substanțe în soluție variază în funcție de concentrația acesteia în ioni H +. Caracteristicile unora dintre cele mai comune indicatori sunt prezentate în Tabelul 12.
indicatori acido-bazic Tabelul 12. Cele mai importante