Diferența de topire a cristaline și amorfe solide
Cea mai importantă diferență - lipsa punctului de topire (față de cristalin) substanțele amorfe. corpuri amorfi nu au nici o formă de rețea cristalină și cel puțin înmoaie de încălzire. Temperatura se ridică în mod continuu ca agent de încălzire. Un exemplu de material amorf poate servi drept sticlă obișnuită. Cred că toată lumea știe că sticla devine din plastic atunci când este încălzit și la ieșirea din glassmakers produc produse diverse.
aceeași substanță cristalină are o temperatură specifică de topire. De exemplu, gheața se topește la temperatura de 0 grade Celsius. Pe masura ce corpul de încălzire cristalin acestuia crește temperatura la temperatura de topire. După atingerea acestei temperaturi, încălzirea este continuată în continuare, temperatura corpului rămâne stabilă: distrugerea rețelei cristaline sunt substanțe. După topirea completă (solid în stare lichidă a trecut), temperatura începe să crească din nou.
Mai clar acest lucru poate fi văzut în grafic
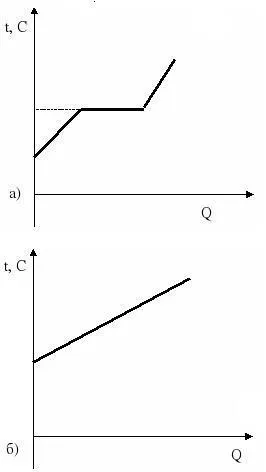
Figura de sus prezintă dependența temperaturii cristalului inferior - amorf.
Există o întrebare interesantă? Cere-i la comunitatea noastră, vom găsi cu siguranță răspunsul!
Împărtășiți experiența și cunoștințele, câștiga recompense și reputația, face prieteni noi si interesante!
Pune întrebări interesante, să calitativ răspunsurile și să câștige bani. Mai mult ..
Statistici Proiect lunare
Noii membri: 6844
Subiecte create: 32838
Răspunsurile scrise: 88,673
Punctele acumulate de reputație: 1369421
Conexiunea la server.