Densitatea materialului de expresie prin masa moleculei și numărul de molecule pe unitatea de volum
Deoarece toate substanțele constau din molecule, toată suma în greutate a maselor de molecule în același mod, de exemplu, ca o serie de pachete cu mazăre suma maselor tuturor mazăre, care sunt în pachet. Este ușor pentru a determina greutatea de mazăre - pachet de mazăre trebuie să cântărească. Dar dacă toate mazăre au fost egale, atunci masa de mazăre poate fi determinată prin înmulțirea greutatea unui bob de mazăre cu privire la numărul de mazăre în pachet.
Moleculele substanței pure sunt identice, și, prin urmare, de exemplu, masa picăturilor de apă este produsul dintre masa unei molecule de apă la numărul de molecule în picătură.
Densitatea substanței arată ceea ce este masa de 1 m 3 a substanței. Densitatea gazului de oxigen, de exemplu, 1,43 kg / m3. Acest număr poate fi obținută prin multiplicarea masei unei molecule de oxigen la numărul de molecule conținute în 1 m3 din volumul său.
Densitatea substanței este produsul masa unei singure molecule de substanță asupra numărului de molecule pe unitatea de volum.
Desigur, practic densitatea materiei sunt numărate greșit, dar într-un mod mai simplu - în greutate corporală și volumul său. Dar, cunoscând densitatea substanței și masa unei molecule, se poate determina numărul de molecule în 1 m3 de material care nu poate fi calculată în alt mod. Pentru a găsi numărul de molecule în 1 m3 substanțe de densitate trebuie împărțit la masa uneia dintre molecula sa, greutatea molecula este determinată empiric.
In acest fel, de exemplu, calculat în 1m3 de apă pur 3,34 * 28 molecule octombrie și în 1 m3 de oxigen-10 2.7 * 25. Aceste numere sunt atât de enorm încât, desigur, nu este posibil de a conta direct molecula. Chiar dacă eliberarea de 1 m3 de oxigen la 1 milion de molecule pe secundă, și ar avea nevoie de 900 de miliarde de ani.
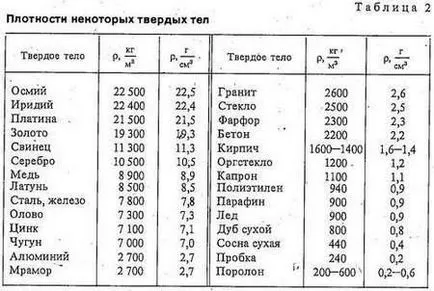
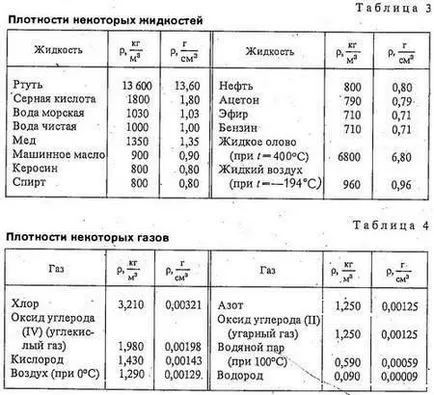
Tabelele 2-4 sunt date anumită densitate de solide, lichide și gaze. Luați în considerare masa și observați diferența mare de densitatea densitatea de gaz a solidelor și lichidelor.
Densitatea gazului de oxigen de 1,43 kg / m3. Datorită acestui gaz puternic de răcire prin compresie și oxigen lichid preparat, care are o densitate de 1140 kg / m3. Și oxigenul gazos și lichid este format din identice molecular - molecule de oxigen. De ce este atât de greu - de aproape 1000 de ori - diferite în densitatea lor? Să ne amintim că moleculele de gaz sunt la distanțe mari unul de altul decât în lichide. Prin urmare, numărul de molecule per 1 m3 de gaz este mai mic de 1 m3 de lichid.
Întrebări. 1. Așa cum exprimată prin densitatea materialului prin masa moleculei și numărul de molecule în 1 m3? 2. De ce este densitatea gazului mai mică decât densitatea de lichide sau solide? 3. Ce trebuie să știți pentru a determina numărul de molecule în 1 m3 de substanță?
Exerciții. 1. Densitatea apei la 100 ° C este de 950 kg / m3, iar densitatea maximă a vaporilor de apă la aceeași temperatură, 0,590 kg / m3. Cum se explica diferența dintre densitățile de apă și abur? 2. Densitatea de hidrogen gazos de 0,09 kg / m3, iar hidrogenul solid 80 kg / m3. Introduceți motivul pentru această diferență. 3. De ce gazul comprimat are o densitate mai mare decât necomprimat? 4. Verificați dacă în 1 m3 de apă conținută 3,34 * 28 octombrie molecule. Greutatea unei molecule de apă este egală cu 2,99 / 10 până la 26 kg.