Curentul electric in electroliti

Acasă | Despre noi | feedback-ul
Electroliți numit mediu conductor, în care fluxul de curent electric este însoțit de transferul de material. Cei liberi purtătorilor de sarcină în electroliți sunt ioni încărcați pozitiv și negativ. Pentru mulți electroliți sunt compuși ai metalelor cu metaloidelor în stare topită, precum și unele solide. Cu toate acestea, principalii reprezentanți ai electroliti sunt larg utilizate în domeniu sunt soluții apoase de acizi anorganici, săruri și baze.
Trecerea curentului electric prin electrolit însoțită de eliberarea de substanțe pe electrozi. Acest fenomen se numește electroliza.
Curentul electric în electrolit se deplasează ionii de ambele semne în direcții opuse. ioni pozitivi trece la electrodul negativ (catod) și ioni negativi - un electrod pozitiv (anod). ionii ambelor semne apar în soluții apoase de săruri, acizi și baze, ca rezultat al scindării porțiunii molecule neutre. Acest fenomen se numește disociere electrolitica. De exemplu, clorura de cupru, CuCI2 în soluție apoasă disociază în ioni și clor cupru:
In multe cazuri, electroliza este însoțită de reacții secundare ale produșilor de descompunere a evoluat la electrozi. Un exemplu este electroliza unei soluții apoase de sulfat de cupru CuSO4 (sulfat de cupru), în cazul în care electrozii sunt coborâte în electrolit, realizat din cupru.
Disocierea molecule de sulfat de cupru are loc conform schemei
atomi de cupru neutre sunt depuse sub forma unui precipitat solid pe catod. Acest lucru face posibilă obținerea cuprului chimic pură. Ion anod dă doi electroni și devine SO4 radical neutru intră într-o reacție secundară cu un anod de cupru:
Rezultată sulfatul de cupru molecula merge în soluție.
Astfel, prin trecerea curentului electric printr-o soluție apoasă de sulfat de cupru se dizolvă anod de cupru și depunerea cuprului pe catod. Concentrația soluției de sulfat de cupru nu este schimbat.
lege electroliza a fost stabilită experimental de fizicianul englez Michael Faraday în 1833. legea lui Faraday determină numărul de produse primare, eliberate la electrozi în timpul electrolizei:
m substanță în masă a evoluat la electrodul este direct proporțională cu Q. încărcare a trecut prin electrolit:
Valoarea lui k se numește echivalentul electrochimic.
Mass evoluat pe materialul electrodului egal cu masa ionilor vin la electrodul:
Aici, m0 și q0 - masa și de încărcare a ionului, N- numărul de ioni ajung la un electrod la trecerea prin electrolitul rechizitoriul Q. Astfel, electrochimică echivalentă k este raportul dintre m0 masa ion a substanței q0 sale de încărcare.
Deoarece sarcina ionului este produsul valența substanței asupra n sarcina electrica elementara e (q0 = ne), expresia pentru echivalentul electrochimic al k poate fi scrisă ca
Aici, NA - numărul lui Avogadro, M = m0 NA - masa molară a substanței,
F = ENA - Faraday constantă.
F = ena = 96485 C / mol.
Faraday constantă este numeric egală cu încărcătura, care trebuie să treacă prin electrolit pentru a separa la electrodul de un mol de substanță monovalent.
legea lui Faraday de electroliză devine:
Fenomenul electroliză este utilizat pe scară largă în producția industrială modernă.
§21. Curentul electric în gaze
În gazele naturale de stat - izolator. În condiții normale, în gazul sunt aproape nici purtatori de sarcina, mișcarea care ar putea crea un curent electric.
Pentru a deveni gaz povodyaschim, este necesar să se creeze un particule libere încărcate, adică. E. Convertit molecule neutre (sau atomi) în ioni.
Gaz-conductor - este un gaz ionizat.
Ionizarea gaza.- această dezintegrare a atomilor neutri sau molecule în ioni pozitivi și electroni prin separarea electronilor din atomi. Ionizare are loc prin încălzirea gazului sau expunerea la radiatii (UV, raze X, radioactive) explică dezintegrarea atomilor si moleculelor de coliziune la viteze mari.
Procesul este însoțit de ionizare a gazului este întotdeauna opusă pentru neutru procesul de recuperare a moleculelor de ioni cu sarcină oppositely datorate (Coulomb) atracția electrică. Un astfel de proces este numit recombinare de particule încărcate.
gaz încetează să mai fie un vehicul, în cazul în care ionizarea se opreste, acest lucru se datorează recombinării (reunire particulelor încărcate oppositely).
descărcare în gaz - este un curent electric în gazele ionizate. purtătorilor de sarcină sunt ioni pozitivi și electroni. Deversarea de gaz are loc în tubul de evacuare (tuburi), atunci când este supus unui câmp electric sau magnetic.
Există o descărcare în gaz separat și non-self.
Descărcarea de gestiune există numai prin ionizator extern, numit de evacuare a gazelor dependente.
Dependența curentului în gazul de tensiunea aplicată este numită caracteristica curent-tensiune.
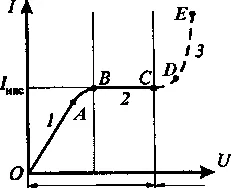
Odată cu creșterea tensiunii, electronii primari sunt accelerați de câmpul electric, începe șoc ioniza moleculele de gaz, formând electroni secundari și ioni. Numărul total de electroni și ioni vor crește pe măsură ce se apropie de electroni anodul unei avalanșe. Acest lucru determină o creștere a curentului la porțiunea de CD-uri. Procedeul descris este numit un impact ionizare.
tensiuni la ionii pozitivi semnificativi sunt, de asemenea, castiga suficienta energie pentru a ioniza moleculele de gaz, provocând avalanșe de ioni. Creșterile intensitatea curentului sunt aproape fără creșterea tensiunii (segmentul DE).
O multiplicare avalanșă de electroni și ioni conduce la faptul că descărcarea devine independentă. și anume Ea persistă după încetarea ionizatorului externe. Tensiunea la care are loc de descărcare de gaz de tensiune independent, numit defalcare.
eșantion de gaz electric - tranzițional evacuarea gazelor în independentă non-self.
descărcare de gaz independente byvaet4 tipuri:
1.tleyuschy - la presiune joasă (mai multe torr) -nablyudaetsya în tuburi incandescente cu descărcare (lumină fluorescentă) și gaze lasere.
2.iskrovoy - la presiune normală și o intensitate mare câmp electric (fulgere - amperaj la sute de mii de Amperi).
3.koronny - sub presiune normală, într-un câmp electric neuniforma (la vârf, scurgerea de energie).
4.dugovoy - o densitate de curent mare, de joasă tensiune între electrozii (temperatura gazului în arc de canal -5000-6000 grade Celsius); observate la proiectoare, echipamente video de proiecție, sudura, lămpi cu mercur.
La temperaturi suficient de scăzute, toate substanțele sunt în stare solidă. Încălzirea provoacă o tranziție de la solid la lichid și apoi un gaz.
Rezultatele de încălzire suplimentare în ionizarea gazului prin coliziunea atomilor care se mișcă rapid și molecule. Substanța unui nou stat.
O plasma - a patra stare a materiei, cu un grad ridicat de ionizare datorită coliziunii dintre moleculele la o viteză mare, la o temperatură ridicată; găsit în natură: ionosferă - o plasmă slab ionizată, soarele - plasma complet ionizat; plasmă artificială - în lămpi cu descărcare. Plasma este:
Principalele proprietăți plasmatice: - conductivitate electrică ridicată - interacțiune puternică cu electric extern și câmpuri magnetice.
99% din materialul din univers - plasma.
emisie de electroni - fenomenul de emisie de electroni din metale cu energie de electroni a mesajului, egală sau mai mare funcție de muncă.
Funcția de lucru de electroni a metalului - lucrarea care trebuie să fie cheltuite pentru a îndepărta electronul din metal într-un vid.
Funcția de lucru depinde de natura chimică a metalului și puritatea suprafeței lor.
Funcția de lucru este exprimată în electron volți (eV). 1 eV este lucrarea care face intensitatea câmpului electromagnetic, la o sarcină electrică elementară se deplasează între punctele între care diferența de potențial este de 1 V. Deoarece e = 1,6-10- 19 CI, apoi 1 eV = 19 J 1,6-10-.
1. emisie Thermionic - emisia de electroni de metale încălzite. Exemplu de utilizare - tuburi cu vid.
2. photoemission - emisia de electroni din metal sub acțiunea radiației electromagnetice. EXEMPLU -fotodatchiki utilizare.
3. Emisia de electroni secundar - suprafața de emisie a electronilor din metale, semiconductori sau izolatori sub bombardament de electroni fascicul. Raportul dintre electroni secundari la numărul n1 n2 primare, cauzate de emisii, coeficientul de emisie numit electron secundar # 963; = N2 / n1. Exemplu de utilizare - tuburi fotomultiplicatoare.
4. emisie de câmp - emisia de electroni de pe suprafețele metalice prin acțiunea de puternic câmp electric extern.