Coroziunea metalelor și impotrivi
12. Principalele tipuri de coroziune din metal
Coroziunea - un proces de distrugere de metal sub influența mediului chimic în contact cu el, care are loc pe interfața de pe suprafață. Spre deosebire de coroziunea metalului eroziunea este distrugerea suprafeței sub influența acțiunii mecanice (de exemplu, jeturi de apă, boabele purtătoare de nisip, și așa mai departe. P.).
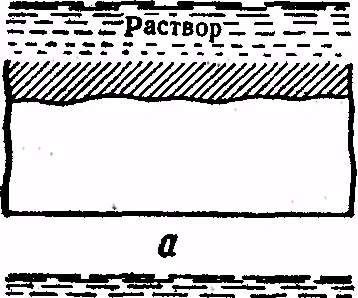
Fig. 8. Tipuri de coroziune:
și - o uniformă, b - blots, a - punctul g - Piting, d - mezhkristal-litnaya e - cracare, w - selective
Coroziunea este un proces eterogen redox care apar la interfața. Coroziunea se poate produce în gazele, în aer, în apă (râu, mare, sol), în soluții de solvenți organici și electrolitica-ing. Distinge chimică și coroziunea electrochimică a metalelor.
Amploarea pierderilor de coroziune, sunt extrem de ridicate în economia mondială. Literalmente miliarde de dolari sunt cheltuite în dezvoltarea țărilor din industria cială pentru a combate coroziunea metalelor și de înlocuire derivate din TION a coroziunii a structurilor metalice și a dispozitivelor. Astfel, din metal anti-coroziune este una dintre gravitate, probleme lte în producție și în domeniul transportului. tipuri de coroziune sunt prezentate în Fig. 8. Poate fi uniform (a); locale (b - blots, un punct - g - corodare); interkristal-litnoy (intergranulare) (d); fisuri (e); selectiv (g).
13. Tipurile de coroziune din metal
coroziune chimică - este distrugerea oxidării metalului în mediu fără apariția curentului electric în sistem.
Coroziunea în aer, la temperaturi diferite. Sub acțiunea aerului sau unele metale gaz își schimbă starea într-o suprafață, natura și amploarea modificărilor sunt definite ca proprietăți ale metalului, precum și proprietățile și compoziția mediului de gaz în contact cu metalul. În unele cazuri, se formează numai un strat foarte subțire de produse (potuskne-set, întunecare recoacere), dar de multe ori sub influența gazului are loc metalic coroziv puternic (de exemplu, depozite de proces rzhavle de fier în aerul umed) pe suprafața metalică. In oxidarea fierului se formează în funcție de condițiile de trei straturi de oxid conținând FeO, Fe3 O4 și Fe2 O3.
Când metalul oxidat la suprafața sa un strat de oxi-și care, îngroșarea acestuia, tot din ce în ce mai mult de-complică accesul oxigenului la suprafața metalică, astfel încât rata de film de multe ori îngroșare nu este viteza de oxidare chimică a pro-cesiunii și vitezele determinate Tew difuzia ionilor metalici sau oxigenului prin grosimea peliculei de oxid.
Difuziunea prin peliculă de oxid depinde în mod esențial de prezența defectelor. La temperatura camerei, un film de oxid este adesea iso liruet metal din accesul aerului și oxidarea ulterioară a vitezei de metal devine neglijabil. oxidarea metalului în aer are loc mai rapid la temperaturi ridicate, deoarece difuzia prin venitul stratului de oxid la o rată mai mare.
La presiune normală, oxidarea metalului în diferite temperaturi yn supuse interval unor legi diferite. De exemplu, aluminiul din aerul uscat este acoperit rapid cu un strat de oxid tol-schinoy aproximativ 30 Angstromi, după care oxidarea încetează practic.
Cele mai multe ecuații matematice care descriu oxidarea metalelor (in grosimea peliculei coordonate - timp), în condiții normale, au logaritmice sau exponențială. De exemplu, în cazul în care - grosimea filmului; K și - constante; t - timpul de oxidare. Curbe y = f (t) este prezentat în Fig.9 (L și C). Deasupra unei legi parabolice (curba F) îngroșarea temperaturii peliculei de oxid în funcție de temperatură este exprimat.
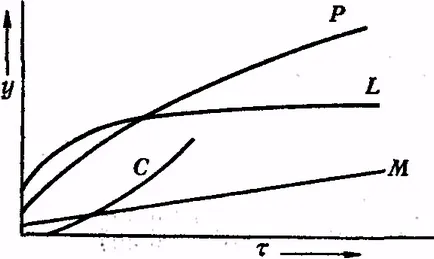
Fig. 9. Diferite tipuri de curbe P - curbe parabolice, L - logaritmice curba C - curba concavă, o linie dreaptă M
Cel mai simplu caz al unei legi parabolice îndeplinește ecuația
în cazul în care - în momentul în care grosimea peliculei de oxid t de la începutul oxid-TION și K și K „- constante în funcție de temperatură, dar nu depind de timp.
La o mică valoare de K (ceea ce este adevărat pentru majoritatea obișnuite de metal-TION la temperaturi nu prea ridicate), metalul pe care pelicula de oxid ingroasa parabolic pot fi luate în considerare în domeniu să fie suficient de rezistent la oxidare, un film de oxid daca nu este un raster skivaetsya. La modulari-peratures mai mari, mai ales într-o atmosferă care conține o cantitate mică de tip acru sau agenți de oxidare numai slab, oxidare merge de multe ori cu o viteză aproape constantă clorhidric. Acesta poate fi un caz extrem, atunci când rata de oxidare este independentă de timp, atunci grosimea filmului poate fi exprimată prin ecuația neniem-o creștere a filmelor de oxid pe cristalele de metal y = Kτ + K` (linia M în grafic)
Practic, foarte importantă pro-proces de coroziune fierului în condiții atmosferice la tempera-runde obișnuite (rugină). Ruginirea de fier se produce foarte rapid în aer umed. Trebuie remarcat faptul că procesul merge rugina de fier, cu o intensitate maximă la o umiditate care nu răspunde complet satura aerul cu vapori de apă. Când viteza de coroziune la o umiditate relativă de 65%, comparativ-mare, și peste 65%, creste foarte repede, cu toate acestea, umiditatea relativă de 65% umiditate relativă numit clorhidric critică. Când rugina critică și mai mare de umiditate, fiind higroscopice, atrage puternic și reține umezeala. Inițial galben-portocaliu rugina are o structură de gel, dar treptat formarea de oxid cristalin
hidroxid (FeO) OH. Cristalizarea începe în interiorul strat ruginit ranguri, în care învelișul exterior al gelului, care este foarte fragil, descompune în stare uscată. Produsele finale ale procesului rzhavle-TION sunt a- și y-modificare FeO (OH) și Fe3 04.
Oxidarea metalelor în aer este amplificată în prezența impurităților de dioxid de sulf, dioxid de carbon, halogeni, acizi, și vapori de apă. Astfel, formate pe suprafața sulfatului metalic (sulfiți sau sulfuri), carbonați și, eventual, hidroxizi, co-torye descompun rapid, oferind oxizi secundari sunt mai poroase și mai puțin protejează metalul de coroziune. În timpul coroziunea metalului joacă un rol important în contact cu alte metale sau chiar solide, cum ar fi prezența prafului de pe suprafața metalică. Coroziunea de aer cu praf este considerabilă, dar mai intensă decât în praf pură.
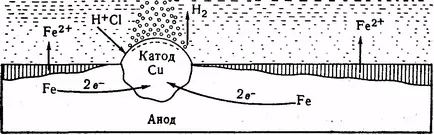
Fig. 10. Circuitul cu includerea coroziunii fierului a cuprului
coroziune galvanică. Distrugerea metalului într-un mediu cu electro-Lits apariție în cadrul sistemului de energie electrică se numește coroziune electro-chimice. Practic, orice metal conține impurități ale altor metale. Prin urmare, într-un sistem de mediu electrolitic al metalului de bază și o impuritate metalică P formează un număr mare de celule micro-galvanice. Apariția unor astfel de elemente pot fi explicate; Ob bazate pe valori ale potențialelor de electrod standard, (tabelul 3).. Fiecare membru al acestei serii, în picioare de mai sus are un potențial mai negativ decât vecinul său de mai jos. Firește, în cazul în care doi conductor metalic este de a conecta soluția și plasată într-o soluție care conține ioni de ele, mai activ metalul se va coroda, în timp ce la coroziune mai puțin activă nu este o sub-jected.
Fig. 10 prezintă placa de fier cu incluziuni de cupru. Soluția de electrolit (HCl), acest sistem este un element galvanizat nical care este fier ano-house în lanțul interior (E ° = - 0,44), și de cupru - catod (E ° = 0,337 in). Atomii de fier, cupru transferă doi electroni trec în soluție sub formă de ioni de Fe 2+ la ionii de clor medii și formează clorură de fier (II). Ionii de hidrogen trece la catod (pentru cupru). Aici insereaza zhayutsya:
Hidrogenul rezultat este parțial păstrat suprafața catodului este îndepărtat parțial sub formă de bule. În cazul în care nu este furnizat la oxigenul catod, apoi, treptat, începe polarizarea. potențial catodic devine mai negativ, și în cele din urmă în comparație cu potențialele din anod, care cauzează o încetare a curentului și a coroziunii. Aerul liber LES-ceai de oxigen la catod se produce depot polarizare
și procesul de coroziune electrochimica merge lin pe. Dacă acest element galvanic în loc de acid clorhidric, pentru a lua soluția de clorură de sodiu, în general, în timpul procesului nu ar fi schimbat. Cinstește ar fi doar reacții secundare. La catod, în plus față de hidrogen, hidroxid de sodiu se formează: