cinetică chimică 2
Cinetică chimică ─ doctrina legilor reacții chimice. Cinetica are în vedere două caracteristici importante și interdependente ale reacțiilor: viteza și mecanismul, a căror cunoaștere vă permite să controlați reacțiile, pentru a alege condițiile optime pentru apariția lor.
2.1 Frecvența reacțiilor chimice
viteza de reacție chimică este determinată de numărul de coliziuni reactive particule active care apar pe unitatea de timp pe unitatea de volum (pentru reacție omogenă), sau pe unitatea de interfață (pentru reacții eterogene), duce la formarea unei noi rate reacție chimică veschestva.za acceptă modificarea concentrația molară a substanței per unitate de timp și pentru fiecare volum de reacție unitate. care dintre reactanți Astfel imateriale alege pentru a monitoriza viteza, deoarece acestea sunt interconectate cu ecuația reacției una. De exemplu, concentrația molară a reactantului la un moment dat τ1



concentrația molară arată cât de multe moli de substanță conținută în 1 litru de soluție sau volum amestec gazos, timpul se măsoară în secunde.
Pentru a calcula viteza de reacție, este necesar să se știe cum să se schimbe concentrația unuia dintre reactanți pentru o anumită perioadă de timp. Intervalul de timp mai puțin, experimental găsit de mai aproape de adevarata viteza, t. E. La viteza la moment. Viteza de reacție este întotdeauna pozitiv, astfel încât fracțiunea luată cu semnul minus, în cazul în care studiază modificarea concentrației materialului de pornire în reacția (
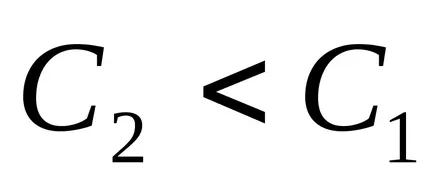
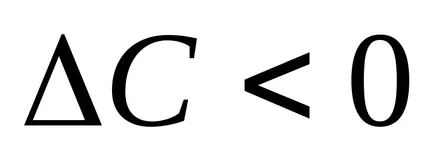
Pentru a determina viteza de reacție a procesului poate fi aleasă astfel încât apariția unei anumite cantități de produs este înregistrată vizual, de exemplu, obținerea de precipitare. Astfel, intervalul de timp din momentul golirii soluțiilor până când precipitatul este invers proporțională cu viteza de reacție, astfel încât 1 /

unde

presiune (în cazul reacțiilor care implică gaz, deoarece concentrația variază în funcție de presiune);
pe gradul de măcinare pentru reacții care implică solide.
2.2 Dependența vitezei de reacție asupra concentrației. Legea de acțiune în masă
Această dependență a fost deschis doi cercetători norvegieni - Guldberg și Waage în 1867 an și oamenii de știință români Beketovym și a numit legea acțiunii de masă: la o temperatură constantă a vitezei de reacție chimică este direct proporțională cu produsul dintre concentrațiile reactanților, combinate într-un grad egal cu coeficientul substanței în ecuația reacției.
Pentru aA reacție + bB = mM + nN drept de acțiune în masă are forma:
unde



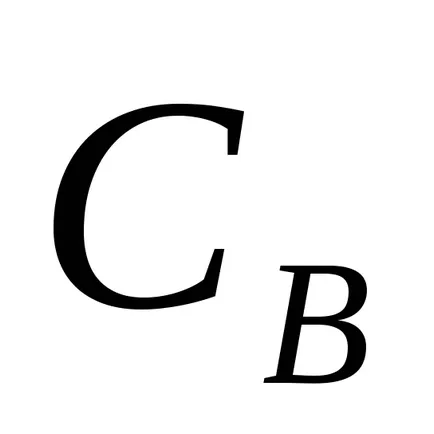
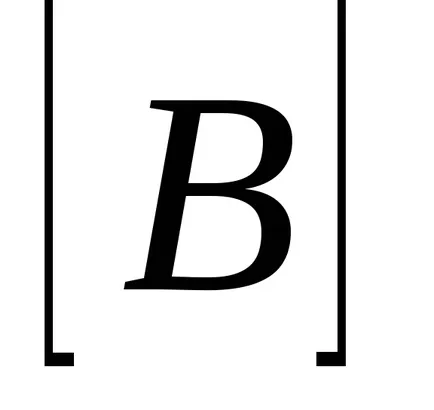
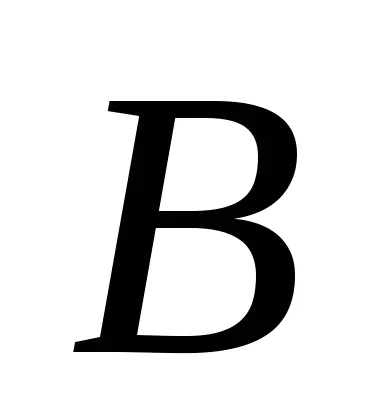

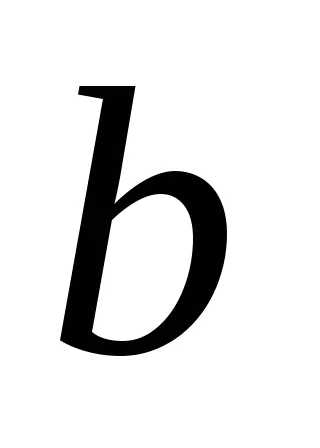
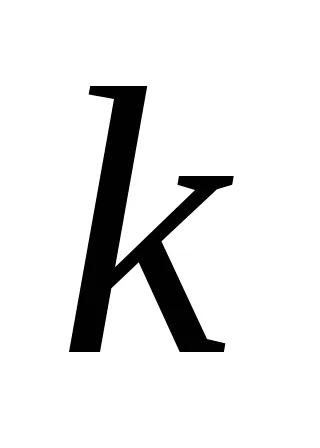
Dacă presupunem că

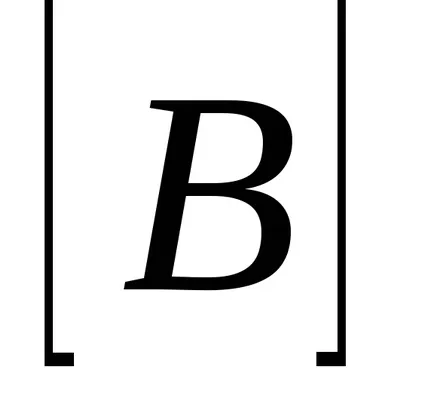
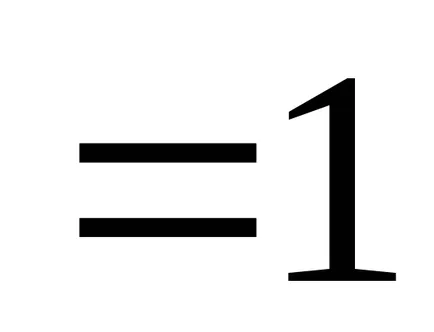
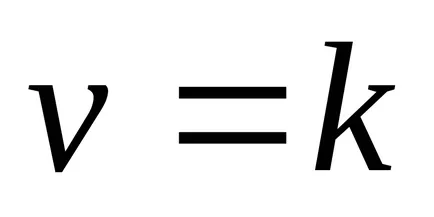
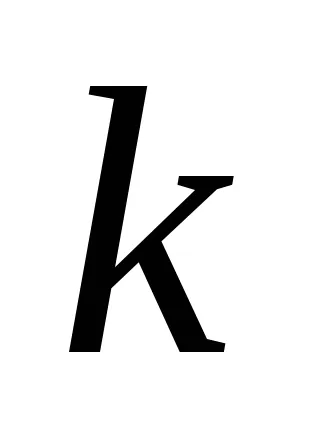
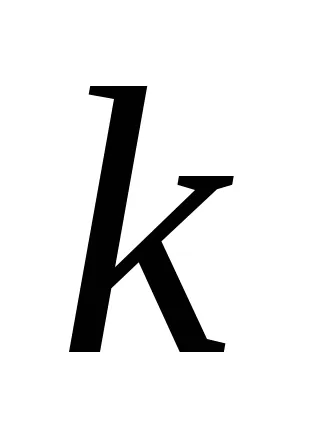
Luați în considerare exemplul unei reacții chimice omogene: