Chiralitate (chimie)
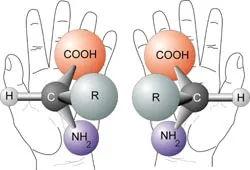
Aminoacizii sunt exemple de molecule chirale
Chiralitv (χειρ antic grecesc -. Mâna) - proprietate a unei molecule să nu fie combinate într-un spațiu cu imaginea sa în oglindă [1]. Termenul se bazează pe vechiul titlu grecesc obiect chiral cel mai ușor de recunoscut - mâini. Astfel, mâinile stânga și dreapta sunt imagini în oglindă, dar nu pot fi combinate între ele în spațiu. In mod similar, moleculele chirale au o proprietate în care nici o axă de rotație oglindă Sn de simetrie. care este echivalentă cu prezența în elementele de molecula chiralitate (axului central și un plan al chiralitate al.). O astfel de formă simetrică în oglindă a compușilor chimici numite enantiomeri.
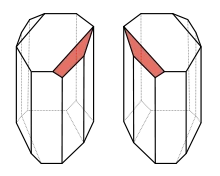
Cristale Enantiomorphous dextrogir și tartrat de levogiră
chiralitate molecular a fost descoperit de Louis Pasteur în 1848. Pasteur a atras atenția asupra faptului că cristalele precipită din soluție racemică -ammoniya tartrat de sodiu. Ei au două forme, care sunt imagini în oglindă care nu coincid unul cu celălalt în spațiu. In contrast, cristalele dextrorotatori individuale de tartrat de amoniu sodiu au aceeași formă cu avioane mici în aceeași direcție. Pasteur a petrecut cristalizarea similară cu treisprezece compuși puri enantiomeric (diferite tarteaților și acid tartric), iar cele șase tarteaților racemice și a concluzionat că existența moleculelor chirale și a explicat tip necunoscut anterior de acizi tartrici izomerie enantiomerul - [2].
Interpretarea structurală a chiralitate a devenit posibilă după introducerea 1874 godu J. van't Hoff și J. Le Belem conceptul atom de carbon asimetric, adică atomul de carbon tetraedric cu patru substituenți diferiți. [2]
Conceptul de chiralitate a fost introdus de Lord Kelvin, în sfârșitul secolului al XIX-lea. [3] [4]
Fac apel orice figură geometrică sau grup de puncte, chirale și spune că are chiralitate dacă imaginea sa într-o oglindă plană ideală nu poate fi combinat cu ea.
Textul original (în limba engleză).
Eu numesc orice figură geometrică, sau un grup de puncte, chiral, și spune că are chiralitate, în cazul în care imaginea sa în oglindă plan, realizat în mod ideal, nu poate fi adus pentru a coincide cu ea însăși.
- William T. Kelvin. prelegeri Baltimore asupra dinamicii moleculare și teoria val de lumină, în 1904
Ulterior V. Meyer extins conceptul de chiralitate în compușii cu azot. și G. W. Pope. - atomi de sulf. seleniu și staniu. complecși metalici chiralitate a fost studiată de Werner [5].
Simetrie molecule chirale
Deoarece chiralitatea este caracteristica geometrică, ea poate fi determinată prin referire la aceeași moleculă grupă sau diferite simetrie. Evident, nu este molecule chirale cu centru de inversiune (i) sau planul de simetrie (e), deoarece aceste molecule sunt compuse din două părți identice, care, atunci când se reflectă una în alta, iar reflexia este echivalentă cu molecula părinte. Anterior criteriul geometric al chiralitate formulat după cum urmează: „într-o moleculă chirale nu ar trebui să fie un plan de simetrie și un centru de inversiune.“ Criteriul utilizat în prezent mai precis, ceea ce implică absența unei molecule chirale sunt, de asemenea, axe oglindă pivotantă Sn [1] [6].
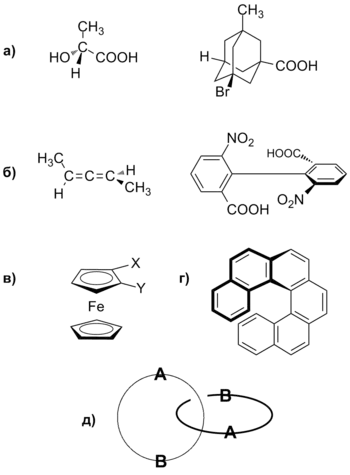
Exemple de molecule având (a) o chiralitate centrală; (B) o chiralitate axială; (C) o chiralitate plană; (G), un chiralitate elicoidal; (D) o chiralitate topologică
În funcție de elementul molecular, a cărui prezență dă naștere la chiralitate, chiralitate din următoarele tipuri:
- centru (centru de chiralitate)
- axial (axa chiralitate)
- Planar (planul chiral)
- elicoidal (în spirală)
- Topologiei. [6] [7]
chiralitate Central
chiralitate central provine din prezența, în centrul chiralitate molecula (centru chiral), care de obicei este un atom de carbon asimetric. 4 având un substituent diferit. centri chirali pot fi, de asemenea atomi de Si. P. S. mai - N [8]. Centrul chiral al derivatului chiralitate adamantane este în mijlocul scheletului de carbon, unde atomii nu [6].
Axial (axial) chiralității
Chiralitate axială apare ca rezultat al unui aranjament neplană substituenților în jurul unei axe - axa chiralitate [9]. axa chiralitate există în asimetrici de alene substituite. sp atom de carbon -Hybrid Allen, are două p orbitali perpendiculare reciproc. suprapunere a acestora cu p orbitalii pe atomii de carbon adiacenți conduce la faptul că substituenții din Allenet minciună în plane reciproc perpendiculare. O situație similară se observă și în bifenililor substituite. în care rotația în jurul legăturii care leagă inelul aromatic. dificil, precum și compușii spirociclici.
planar chiralitate
Planul chiralitate este prezent în derivatul ferocen. de paracyclophanes substituiți și alții. Utilizarea locația intermediară a planului descriu elementele chirale în ceea ce privește chiralitatea planului moleculei [10].
chiralitate elicoidală
caracteristic chiralitate în spirală a compușilor având elemente în formă de spirală sau de elice cu șurub, de exemplu helicenes [11]. Șase inele aromatice în geksagelitsene poate să nu corespundă în același plan, astfel încât formează o spirală, care poate fi răsucit spre stânga sau spre dreapta. Acest tip de chiralitate observate în proteine și acizi nucleici.
Chiralitate topologic
chiralitate topologic datorită prezenței asimetriei structurale caracteristice a supramolecules. de exemplu, catenanes. rotaxanilor. unități moleculare [6].
Compușii chiralitate cu perechea de electroni stereogenic
Aminele. fosfinele. ioni, sulfoniu, oxoniu, sulfoxizi chiralitate pot apărea din cauza mediului spațial al atomilor de azot. fosfor. sulf și oxigen. În ciuda faptului că, în acești compuși au doar trei deputați, al patrulea site-ul de coordonare ocupă o pereche de electroni neîmpărtășită și este apariția unui centru chiral.
aminele chirale diferă de la compuși cu oxigen chirali cu fosfor și sulf ca enantiomeri amine rezultată din atomul de azot stereogenic, rareori poate fi separat, deoarece acestea sunt ușor de transformat într-unul pe altul datorită inversării atomului de azot (calculat energia de activare EA pentru trimetilamina este aproximativ 30 kcal / mol). În același timp, fosfine corespunzătoare sunt supuse la inversiune foarte lent (calculat EA energie de activare pentru trimetilfosfină este de aproximativ 190 kcal / mol) [12]. Excepția de la această caracteristică sunt aminele în care inversiunea azotul este imposibilă, deoarece configurația acestuia este fixat spațial, ca de exemplu în baza Trogera (Eng.).

Chiralitate în chimie anorganică
Multe complexe au chiralitate. Clasic în acest domeniu sunt lucrările lui Werner. 40 a fost sintetizat compuși coordinativi optic activi. De exemplu, complexul octaedru cu ruteniu bipiridina [Ru (bipy) 3] 2+ este chiral, ca trei ligand bipiridină în ea ocupă aranjament chiral în formă de elice.
Comunicarea cu activitatea optică
Compușii chirali și soluțiile lor au capacitatea de a roti planul luminii plan polarizate, care pot fi observate cu ajutorul unui polarimetru. Din acest motiv, compușii chirali sunt de asemenea denumite optic active. sau optic activ.
Un val de lumină care trece prin soluția de substanță optic activă poate fi scrisă ca dreapta și stânga componente polarizate circular, care sunt într-un mediu chiral se propagă cu viteze diferite faze. din cauza căreia există rotație a planului de polarizare a luminii [13].
Chiralitate în biologie
Multe molecule bioactive posedă chiralitate, cu aminoacizi naturali și zaharuri sunt prezentate în natură predominant ca un singur enantiomer. aminoacizi au în principal l configurație și zaharuri - d configurație [14].
Cele două forme enantiomerice ale unei molecule de obicei, au activitate biologică diferită. Acest lucru se datorează faptului că receptorii. enzime. anticorpi și alte elemente ale organismului prezintă, de asemenea, chiralitate și asimetrie structurală între aceste elemente și molecule chirale împiedică interacțiunea lor. De exemplu, enzimele. sunt molecule chirale, prezintă adesea o reactivitate specifică cu privire la unul dintre enantiomeri. Exemple similare sunt de asemenea caracteristice compușilor medicamentoși. Astfel, activitatea biologică posedă doar un singur enantiomer al ibuprofen - (S) - (+) - ibuprofen, în timp ce antipod optic (R) - (-) - ibuprofen este inactiv în corp [15].
Cu rare excepții, naturale aminoacizi și monozaharidele chirali sunt prezentate ca un singur izomer al celor două posibile. Astfel, în compoziția proteinelor sunt aproape exclusiv l-amino acizi, iar ADN-ul și ARN sunt construite doar pe baza -uglevodov d. Această proprietate a compușilor chimici numit homochiral (puritate chirală). Originea și destinația acestui fenomen nu sunt instalate până la sfârșitul anului, dar este adesea asociat cu problema originii vieții [16].