celule electrochimice
La plasarea zinc metalic în soluție de sulfat de cupru O reacție redox:
Atât jumătate de reacție (reducere și oxidare) au loc simultan la locul de contact cu o soluție de zinc. Zincul dă doi electroni cation de cupru este oxidat în același timp.
Dacă vom face opusul și a pus metalul de cupru în soluție de sulfat de zinc, atunci nimic nu se va întâmpla. Păstrați activitatea de metal! Zincul este mai activ decât de cupru - se pierde electroni mai ușor.
In exemplul de mai sus, atât jumătate de reacție a procedat într-un singur loc. Și ce se întâmplă dacă împărțiți reducerea jumătate de reacție și oxidarea? In acest caz, electronii se vor deplasa din reducătorul la oxidant printr-un circuit extern, care va servi ca un conductor de curent electric. Da - fluxul de electroni direcționat nu este nimic, ca un curent electric.
conversia Aparate de energie chimică în energie electrică, numită celula. sau, în termeni simpli, - bateriile electrice.
1. Daniel Element
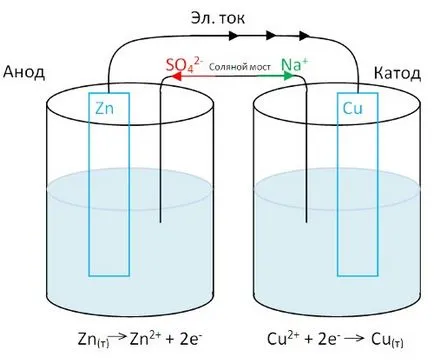
O placă de cupru (electrod negativ - anod) imersat într-un recipient de sulfat de cupru.
Placă de zinc (electrod pozitiv - catod) - o soluție de sulfat de zinc.
Plăcile sunt interconectate printr-un conductor metalic. Dar pentru a afișa curentul electric în circuit, este necesar să se conecteze puntea de sare capacitanță (tub umplut cu saramură concentrată). Sarea punte permite ionilor să se deplaseze dintr-un recipient în altul, soluțiile rămân neutre electric. Ce se întâmplă cu sistemul?
Zinc oxideaza: atomii de zinc devin ioni și trec în soluție. Electronii eliberați deplasa prin un circuit extern la electrodul de cupru, în care reducerea ionilor de cupru. Electronii sosite aici în legătură cu retragerea dintr-o soluție de ioni de cupru. În această formă atomii de cupru, este izolat ca un metal. Cationii punte de sare sunt mutate în vasul cu un electrod de cupru pentru înlocuirea ionilor de cupru consumabile. Anionii puntea de sare sunt mutate într-un recipient dintr-un electrod de zinc, ajută la menținerea unei soluții neutre electric formate cu cationi de zinc.
O diferență de potențial (tensiune) într-un astfel de sistem va fi cu atât mai mare, cu alte metale sunt separate unul de altul în activitatea rând.
2. celulă uscată
Bateria de celule uscate electrice de uz casnic este utilizat, constând din:
- carcasă de zinc (anod);
- situate în interiorul carcasei tijei de grafit (catod).
Tija este înconjurat de un strat de oxid de mangan și negru de fum, este folosit ca strat electrolit de clorură de amoniu și clorură de zinc. Ca rezultat, apar următoarele reacții:
În celula uscată alcalină în loc de clorură de amoniu, acid este utilizat ca un electrolit de mediu alcalin hidroxid de potasiu, ceea ce mărește durata de viață a celulei, deoarece Corpul nu corodează atât de repede
Principalul dezavantaj al celulelor electrochimice este faptul că producția de energie electrică este atât de mult timp până la sfârșitul unuia dintre reactanți.
3. Baterii
Bateriile elimina Principalul dezavantaj al celulelor uscate - o viață scurtă, deoarece acestea pot fi reîncărcate, dar din cauza funcționării lor timp este crescut de mai multe ori și este vechi de câțiva ani.
baterie comună de plumb este format din șase elemente, conectate în serie (cutii). Fiecare bancă dă tensiune 2V, iar suma lor = 12V.
Plumbul folosit ca anod. dioxid de plumb (PbO2) - catodului. Electrozii sunt scufundate într-o soluție de acid sulfuric (SO4 H2). Atunci când se face contactul, următoarele reacții apar în baterie:
Baterie (cu starea intactă a vehiculului) servește numai pentru pornirea motorului. Punctul de plecare în lanț se execută la un curent considerabil (zeci de amperi), astfel încât se scurge bateria foarte repede (câteva minute). După pornirea motorului, toate alimentarea cu energie electrică a vehiculului presupune generatorul. În timpul funcționării motorului generatorului încarcă bateria: reacțiile redox inițiale apar în direcția opusă:
Ca urmare a recuperării de plumb și de dioxid de plumb.
4. Galvanizare
Esența celulelor electrolitice este acela de a pune în aplicare, datorită reacțiilor chimice electrice - recuperare la catod și oxidarea la anod.
Reacția redox are loc la electrozi prin trecerea curentului electric prin celula electrolitică se numește electroliză:
Elementele electrolitice sunt folosite pentru galvanizare. Astfel, un strat subțire de metal aplicată pe suprafața altui metal.
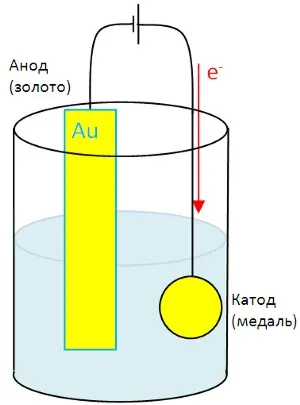
o sursă de alimentare externă este o sursă de curent cu galvanizare. O bară de aur este sursa de ioni de aur, care sunt reduse la suprafața monedei.
Coatings depuse prin electroliză sunt obținute în grosime îngrijite și durabile. Ca urmare, produsul nu arată diferit de versiunea „curată“, iar prețul - mult mai ieftin.