Catalog de fenoli chimice
Nume fenoli în sus, având în vedere faptul că, pentru mamă în conformitate cu regulile structurii IUPAC a menținut numele triviale „fenol“. Numerotarea atomilor de carbon ai inelelor benzenice pornesc de la atomul atașat direct la o grupare hidroxil (dacă este funcția mai veche), și se continuă într-o secvență disponibilă pentru substituenții pentru cel mai mic număr. derivați de fenol monosubstituiți, cum ar fi metilfenol (crezol), pot exista sub forma a trei izomeri structurali - orto -, meta - și para-crezol.
Proprietăți fizice. Fenolii mai ales - substanța cristalină (meta-crezol - lichid) la temperatura camerei. Ei au un miros caracteristic, destul de slab solubil în apă, dar sunt ușor solubile în soluții apoase alcaline. Fenolii forma legături de hidrogen puternice și au un punct de fierbere relativ ridicat.
Metode de halogenbenzeni polucheniya.Poluchenie. După încălzirea de hidroxid de sodiu și clorbenzen presurizat preparat fenolat de sodiu, în prelucrarea ulterioară a care acidul format fenol:
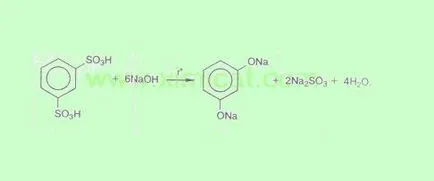
Prepararea acizilor sulfonici aromatici. Reacția este realizată la un acid sulfonic topit cu alcalii. format inițial fenoxizii tratate cu acizi puternici pentru a produce fenol liber. Metoda este utilizată de obicei pentru prepararea fenoli polihidroxilici:
Proprietăți chimice. Fenolii p orbitală atomului de oxigen care formează inelul aromatic cu un singur sistem p. Din cauza acestei interacțiuni, densitatea de electroni pe atomul de oxigen scade si creste in inelul benzenic. Polaritatea OH bond este crescută, iar hidrogenul grupărilor OH devin mai reactive și înlocuite cu ușurință pe metal, chiar sub acțiunea alcalină (față de limitare alcooli monohidroxilici). Mai mult, ca urmare a unei asemenea influențe reciproce în molecula fenol crește reactivitatea nucleului benzenic în poziția orto și para în reacții poziția respectivă de substituție electrofilă (halogenare, nitrare, policondensare, etc.):
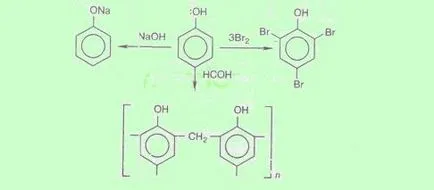
Proprietățile acide se manifestă în reacțiile de fenol cu alcalii (conservate numele vechi „carbolic acid“):
Fenol, cu toate acestea, este un acid foarte slab. La trecerea prin fenolații gazele de carbon sau sulf eliberate soluție de fenol - o astfel de reacție pozyvaet fenol - un acid mai slab decât carbonic și sulfuros:
Proprietățile acide ale fenolilor atenuate atunci când este administrat în inel I tip substituenților și substituenții sunt îmbunătățite atunci când sunt administrați genus II.
Formarea esterilor. Spre deosebire de alcooli, fenoli nu esteri formează atunci când sunt expuse la acizi carboxilici; în acest scop, cloralhidrat hidruri acizi:
Halogenarea. La acțiunea de brom fenol apă un precipitat de 2,4,6-tribromfenol (reacție calitativă pentru detectarea fenol)
Nitrarea. Sub acțiunea 20% fenol acid azotic este ușor transformată într-un amestec de orto - și -nitrofenolov para. Dacă fenol este nitrare cu acid azotic concentrat, compusul format 2,4,6-trinitrofenol - acid tare (picric).
Oxidare. Fenolii sunt ușor de oxidat chiar și sub acțiunea oxigenului aerului. Astfel, în picioare, în aer fenol se transformă treptat culoare roz-roșu. Cu oxidarea viguroasă a produsului fenol cromatului principal de oxidare este o chinonă. fenoli dihidrici sunt oxidate mai ușor. In oxidarea hidrochinonei, chinonă format.