Benzenul - o enciclopedie chimică
Molecula benzen - un hexagon regulat plat cu ext. unghiuri de 120 °, iar distanța dintre atomii de carbon de 0.139 nm. Spectrul UV maxime etanol la 184 nm (lg 4,77), 203,5 nm (lg 3,87), 254,5 nm (lg 2,31).
Benzenul - strămoșul hidrocarburilor aromatice. serii. Chem. Insula Sfântă determinată de prezența în electroni stabil sistem închis moleculă (vezi. Aromaticitate. Combinații aromatice). El este înclinat la interacțiunea donor-acceptor. cu conexiune. având un deficit de electroni; rezultând în formarea slab stabile și există doar în p-rahkompleksy, la- sunt convertite. mai mult prochnyekompleksy. Benzen capacitatea de formare de complex este determinată de tendința sa de electrofil. înlocuire -naib. caracteristic p benzen tsiyam ex.
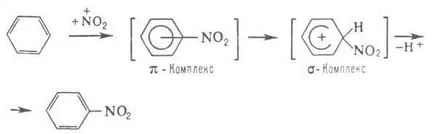
Catalizatori electrofil. de înlocuire - de obicei la tine Lewis, facilitând formarea de intermediar. complecșii și să accelereze în vrac p-TION, de exemplu. clorurare.
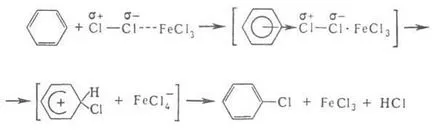
Benzenul este sulfonată la benzensulfonic. este alchilat cu olefină pentru a forma LAB. În funcție de natura substituentului introdus în continuare primul electrofil. preim direcționată de substituție. orto și poziția para sau în poziția meta.
Benzenul caracteristică rezistență ridicată la t-p și oxidanți. Numai peste 650 ° C este parțial convertit. în difenil. peste 750 ° C se descompune în carbon și hidrogen. Benzenul nu este modificat sub acțiunea H2 SrO4 și KMnO4. O2 în prezență. Catalizatori (V, Mo), la 350 ^ 450 ° C, formele de anhidridă maleică. Este hidrogenat la ciclohexan în prezență. decembrie catalizatori (ex. în prezența. Ni la 120-200 ° C și 2,96-6,94 MPa). metale alcaline în NH3 lichid se reduce la 1,4-ciclohexadienă. Când fotochimic. clor aderare convertit. în hexaclorciclohexan. Când iradierea UV este capabil cicloadiție și izomerizare în fulvenic (formula I) și benzvalen (II).
Naib. vechea metoda de bal. producerea de benzen: izolarea din produsele sale pirogazovyh prerăcite de org cocsificarea cărbunilor de absorbție. chiuvete, de ex. Uleiuri kam.-ug. și origine petrolieră; absorbant utilizat pentru separarea de distilare cu abur. Impurități (de ex. Tiofen) benzen brut separate prin hidrotratare din. DOS. Cantitatea de benzen obținut prin reformarea fracției petroliere (C 470-550 °) fierbe la 62-85 ° C; recuperate prin extracție. puritate ridicată Benzenul se obține prin distilare extractivă cu DMF. Benzenul este de asemenea separat de produsele lichide de ulei de piroliză. format din etilenă și propilenă de producție-ve. Cu un exces de toluen dezalchilare resurse care produc benzen ultima la Roe Convențional termic efectuat. Metoda la 600-820 ° C în prezență de H2 și abur, sau catalitica la 227-627 ° C în prezență. zeoliți sau catalizatori de oxid. Naib. benzen selecție avantajoasă din punct de vedere economic din produsele de piroliză. dar resursele acestei surse este insuficientă, așa că io este produs prin reformare. Ponderea Coca-Cola. benzen în soldul total este mic. In laboratoarele de benzen de înaltă puritate a fost sintetizat prin decarboxilarea benzoic la tine.
Specificitatea. detecție p-TION în prezența benzenului. Omologii: amestec de hidrocarburi este agitat cu amoniac p-rum Ni (CN) 2; cu prezența benzen precipitat comp complex. Ni (CN) 2 NH3 (C6 H6).
T pentru benzen. Aux. - 11 ° C, t AUTO APRINDERE .. 534 ° C, 1,5-8% CPV. Acesta irita pielea; benzen în concentrații mari are o acțiune convulsiv; Expunerea repetată la concentrații scăzute, modificările sunt observate în sânge și organele hematopoietice; MPC 5 mg / m 3.
Este transportat în cisterne de cale ferată, echipate cu facilități pentru alimente de încălzire. Benzenul descoperit de Michael Faraday in 1825 in pirolizei ulei de balenă; E. Mitscherlich primul sintetizat în 1833 prin decarboxilarea benzoic la tine.
===
App. Literatura pentru articolul „benzenic“. Sokolov 3. Producția Kharlampovich GD și utilizarea hidrocarburilor aromatice. M. 1980; Efross Gorelik L. S. M. Chemistry and Technology intermediarilor, L. 1980; chimia organică totală. per. din limba engleză. vol. 1, M. 1981, p. 314-455. NN Artamonov.