Aromaticitate Krugosvet enciclopedie
aromat
Aromaticitate - o combinație de anumite proprietăți inerente unui grup mare de compuși aromatici numite respectiv.
Termenul „aromaticitatea“ a fost introdus în 1865 F.Kekule. stabilit o structură de benzen și a propus o formulă pentru ea:
Numele „aromatic“ este asociat cu faptul că există compuși cu miros plăcut, printre derivații de benzen (de exemplu, nitrobenzen are migdale miros).
Kekule a atras atenția asupra faptului că legăturile duble din benzen și derivații săi diferă semnificativ în proprietăți ale dublelor legături în majoritatea compușilor nesaturați. Benzenul a fost reacția de cuplare extrem de dificilă (de exemplu, halogen) pentru legături duble, care sunt destul de ușor în cazul compușilor nesaturați.
Mai mult, sa constatat că orto -dihlorbenzol (atomii de clor sunt cei doi atomi de carbon adiacenți) nu are izomeri, care ar putea fi de așteptat pe baza formulei structurale propuse pentru aceasta, în care cei doi atomi de Cl sunt situate la o legătură simplă sau o legătură dublă:
Ca rezultat, Kekule a sugerat denumire de comunicare în oscilant benzen, adică oscilant. De-a lungul timpului, această ipoteză a fost dezvoltată în continuare și a fost îmbunătățit.
Cea mai caracteristică reacție de substituție benzenului de atomi de hidrogen. Explorarea benzenul Chimia a arătat că înlocuirea unui atom de hidrogen pe orice grup particular, și, mai presus de toate, un efect previzibil asupra reactivității atomilor de hidrogen rămași.
Dacă nucleul benzenic pentru a introduce grupa trage electroni din nucleu (de exemplu, metil), halogenarea ulterioară conduce la substituția în poziția orto și poziția para. Atunci când se administrează grupări elektronopodayuschey (de exemplu, carboxil) halogen ghidat în poziția meta:
Pentru o lungă perioadă de timp aromaticitate considerat un set de proprietăți chimice specificate, dar indicații mai precise, pe baza particularităților structurii compușilor aromatici s-au găsit treptat.
Structura electronică a benzenului și a compușilor înrudiți, în sensul modern este după cum urmează. În formarea legăturilor duble participă p atomi de carbon electroni orbitali (regiunea cea mai probabil amplasarea unui electron în spațiu) ale electronilor sunt sub formă de optari în vrac. În cazul benzenului vzaimoperekryvayutsya orbital formând inelul orbital în care sunt aranjate toate p-electronii ale moleculei:
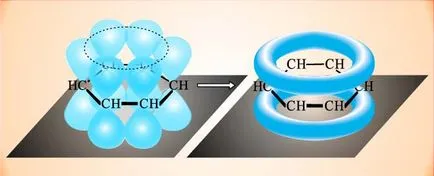
Rezultatul este un singur electron shell închis, sistemul capătă o stabilitate ridicată. Fixe legături simple și duble în benzen lipsesc, toate C-C mediate și sunt echivalente, atât de des folosit pentru a se referi la aromaticitatea simbolului inel plasat în interiorul buclei:
In orbitalii ciclice care rezultă se produce curent inelar care poate fi detectată prin măsurători speciale, indicând în continuare compus aromaticitate.
Au aromaticitate molecule ciclice plane cu numărul de electroni (m), combinate într-un sistem de inel unic, trebuie să corespundă regulii Huckel:
m = 4n + 2 (n = 0, 1, 2, 3), n - numărul de numere naturale
Mai jos sunt prezentate primele trei reprezentant al unui număr de molecule aromatice care corespund regulii Huckel: cation ciclopropenă. benzen și naftalen.
Extinderea conceptului de „aromaticitate“ a permis să aplice acest termen la compuși nebenzolnogo tip, dar având în același timp, un set de structură chimică și trăsături caracteristice ale derivaților de benzen.
În unii compuși, în care o parte a ciclului sunt atomi de O, S sau N, cum ar fi furanil, tiofenil, pirolil cum ar fi benzen există echilibru - în conformitate cu regula Huckel - shestielektronnaya sistem închis. Patru P- electroni (marcate cu albastru în figură) oferă ciclu legături duble și doi electroni S- (marcate cu roșu) produc oxigen, sulf sau azot, având o singură pereche de electroni.
Aromatic poate fi nu numai plane molecule ciclice, dar, de asemenea, structură voluminoasă, de exemplu, molecula de tip sandwich (ferocen dibenzolhrom.) Și anumite borani cadru:
În cazul structurilor în vrac în schimb regula Huckel aplică reguli diferite pentru determinarea numărului de electroni, care are loc atunci când aromaticitate. Cu toate acestea, în toate aceste cazuri, acolo aromaticitate caracteristici principale: o coajă de electroni închis, stabilitate ridicată a moleculei, predilecția substituției reacțiilor și efectul introducerii unui substituent asupra reactivității altor centre reactive în moleculă.
Garrett P. totală chimie organică. per. din limba engleză. M. 1981
Ohlobystin O. Viața și moartea ideilor chimice. M. 1989