8 curs de clasă chimie, curs de învățare la distanță, Chimie, clasa a 8-oxizi și proprietăți chimice de bază
Te-ai întâlnit cu clasa „Oxide“ oxizi de clasificare.
Este important să învețe să distingă oxizi acide, bazice, ca și produsele lor de reacție cu apă reprezintă diferite clase de compuși anorganici.
În cazul în care chiar și acești oxizi distinge rău, trebuie să ne întoarcem la lecția anterioară și de a înțelege diferențele dintre oxizi acizi din principal.
Sper că ați învățat să se facă distincția între oxizi de bază și acide.
Și astfel, proprietățile chimice ale oxizilor:
1. Interacțiunea cu oxizi de apă. Interacțiunea oxizilor solubili în apă formează hidroxizi. Cu alte cuvinte, dacă oxihidroxid corespunde solubil, oxidul reacționează cu apa este posibila.
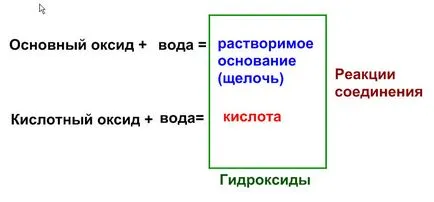
1) Reacția oxizilor de bază cu apă.
Susținem cazul. oxid de sodiu - un oxid bazic, deoarece acest lucru este egal cu valența oxidului metalic este 1. Conform prezentei scheme, reacția are loc cu formarea unei baze solubile.
Formam formula de bază obținută:
valența de sodiu este 1, deci formula de hidroxid de sodiu
Conform Tabelului solubilității - este solubilă de bază (alcaline), astfel, o astfel de reacție este posibilă.
O parte din ecuația completă:
Na2O + H2O = 2NaOH
Deoarece oxidul de bază acest oxid bariya-, atunci ea corespunde unei baze - Ba (OH) 2. Dacă vă amintiți, numărul de grupări hidroxil este determinată de valența metalului. Bariu - Grupul 2 elemente, valența este egal cu 2.
Tabelul Solubilitatea este determinată ca fiind solubilă de bază (alcaline). Prin urmare, o astfel de reacție este posibilă.
Ecuația de reacție: BaO + H2O = Ba (OH) 2
Exemplul 3.
Bază de oxid de cupru (II) corespunde bazei de Cu (OH) 2. Această bază este insolubilă (vezi. Solubilitate Tabelul). Prin urmare, o astfel de reacție nu poate avea loc.
În scris aceste ecuații reacții folosesc un raționament similar.
2.Vzaimodeystvie acide de apă-oxid
oxid de sulf (IV) este acid, deoarece este un oxid nemetalic, în care sulful are o valență egal cu 4.
Formează formula acidă corespunzătoare. Acizii de pe teren, în primul rând scris hidrogenul și oxigenul din ultimul loc. Se înregistrează mărcile de ordine, hidrogen, sulf, oxigen. Numărul de atomi din fiecare element este determinată din partea stângă a ecuației:
SO2 + H2O = H2SO3

Rețineți că formula hidroxizi acizi obținuți prin simpla adăugare de oxizi formule si apa. Această tehnică poate fi utilizat și atunci când aveți nevoie pentru a face o formulă corespunzătoare acestui oxid de acid.
P2O5 + H2O = [H2P2O6] = 2HPO3 sau P2O5 + 3H2O = 2H3PO4
Formula din paranteze - este un record intermediar, în cazul în care numărul atomilor tuturor elementelor - este un număr par. A scăzut cu 2, obținem formula dorită. 2 devine un factor. În al doilea caz, un acid fosforic (formula ați învățat) în apă fierbinte. Coeficienții sunt aranjate cunoscute pe care doriți.
Nu uitați, acizi și baze sunt nume comun - hidroxizi.
Interacțiunea oxizilor de bază și amfoteri cu acizi.
oxizi de bază + Acid = sare și apă.
Aceste reacții procedează în funcție de tipul de schimb.
Exemplul 1.
BaO + HNO3
pe partea dreaptă a ecuației este necesară pentru a sărurilor cu formula: înregistra lângă metalul, formând un oxid bazic - Ba, și un rest de acid NO3 acid azotic. Asigurați-o sare cu formula valență apă formula append pe partea dreaptă a ecuației și aranja coeficienți.
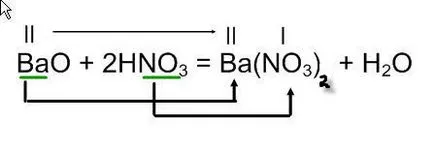
Ca rezultat al reacției oxidului de bariu cu acid azotic este format din azotat de bariu și apă.
Exemplul 2.
K2O + = H2SO4
Sarea rezultată a reacției (în partea dreaptă a ecuației) scrierea primului loc de potasiu metalic la vtorom- acid sulfuric reziduu SO4 kicloty
Conform valență formează sarea coeficienților formula, formula și verificare de umplere cu apă.
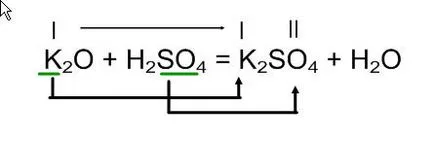
Interacțiunea oxizilor de potasiu cu acid sulfuric pentru a produce sulfat de potasiu și apă.
reacție ecuații similare este în conformitate cu acest algoritm.
oxizi reacționează cu baze acide solubile (alcaline). Amintiți-vă ce motive fac parte din grupul de substanțe alcaline.
Oxidul de acid + = sare alcalină + apa
Exemplul 1.
KOH + CO2 =
În acest caz, pentru a face o sare cu formula, este necesar să se înțeleagă ce corespunde oxid acide de acid.
În partea dreaptă a ecuației, piese de discuri sare: bază metalică, și reziduuri K de acid CO3 din H2CO3 acidă. care corespunde cu CO2 oxizi de acid. Apoi fă o sare conform formulei de valență anexați partea dreaptă a ecuației și aranja raporturi de apă.
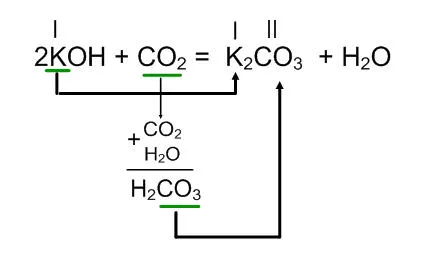
Interacțiunea dintre hidroxid de potasiu (alcaline) cu bioxid de carbon gazos (monoxid de carbon (IV)) sunt formate cu carbonat de sodiu și apă.
Exemplul 2.
Ba (OH) 2 + SO3
Pentru algoritmul echivaleaza descris mai sus:
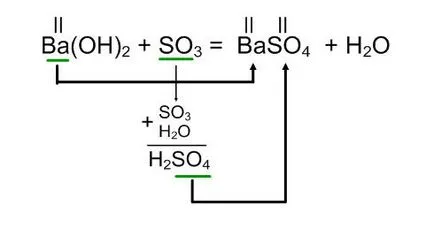
Reacția de hidroxid de bariu, cu un oxid de sulf (VI) este format din sulfat de bariu și apă.
A petrecut aproape această secvență de acțiuni.
Și într-o proprietate mai generală a oxizilor:
Interacțiunea de oxizi acide și bazice între ele.
Oxidul acid + = sare de oxid bazic
Exemplul 1.
Na2O + P2O5 =
Reacția sării acidului este obținut, ceea ce corespunde unui anumit oxid. Algoritmul este similar cu algoritmul de compilare oxid acid ecuații interacțiunea cu o bază.
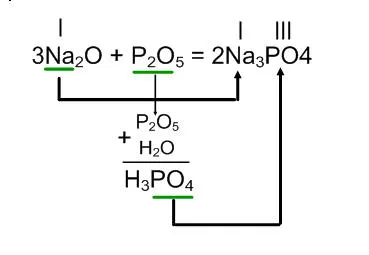
Reacția de oxid de sodiu, oxid de fosfor (V) este format cu fosfat de sodiu.
Exemplul 2.
BaO + SO3 =
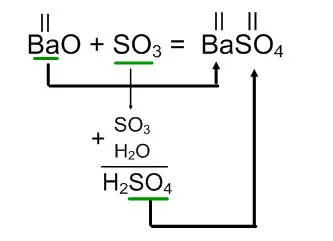
Reacția oxidului de bariu cu un oxid de sulf (VI) este format din sulfat de bariu.
Petrecut algoritmul acțiunilor.
Am examinat proprietățile chimice ale oxizilor care sunt comune pentru oxizi de formare a sărurilor (acide, bazice). Oxizii cu proprietăți specifice, vom ajunge treptat cunoștință cu alte subiecte.
Pentru a rezuma și prezenta proprietățile generale ale acizilor și primirea sub formă de tabele.
Tabel 1. Proprietăți chimice.