6 fosfor, fosfuri
Fosforul, Fosfuri. Fosfină. oxizi de fosfor (III) și (V). Orto-, meta- și acid pirofosforic. Ortofosfat. Esterii acidului fosforic
6.1. Fosforul, fosfină, fosfat
Ca azot, fosfor - un metaloid, dar nemetallichnost lui nu este atât de pronunțat, pe. Principalele motive pentru aceste diferențe, concluzionăm sunt mai mari în rază atomice și în apariția d-orbitalii stratului exterior. Creșterea atomului de timp măsură conduce la o slăbire a exterior- conexiune sunt electroni cu nucleul. Acest lucru duce la o tranziție ușoară-lea de electroni în stare excitată și face ca element de chimie diferă în mod semnificativ de chimie de azot. Aceasta tinde să apară ca o manifestare inerentă a metalelor obișnuite. Spre deosebire de azot, fosfor nu gaz, ci o structură cristalină solidă. Una din numeroasele modificări sale alo-tropic - fosfor negru - semiconductor. Kis-lorodnye compus mai durabil, și funcțiile oxidativă-TION în astfel de compuși în care este posibil de oxidare stat 5, complet absentă în ambii oxizi și acizi y.
* Fiind în natură
Cel mai bogat în depozitele de apatită din lume sunt situate în apropierea orașului Kirovsk pe Peninsula Kola. Fosforit destul de răspândită, Nena în Urali, regiunea Volga, Siberia, Kazahstan, Estonia, Be-lorussii et al. Mari depozite de fosfat sunt în Africa de Nord, Siria și Statele Unite ale Americii.
Fosforul preparat din apatit sau fosforit. Recente amestecat cu cărbune (cocs) și nisip, calcinat electron-parametru cuptor la 1500 ° C
vapori cu fosfor formați sunt condensate în receptor sub apă.
Fosforul poate exista în mai multe modificări. On-valoare, există până la 11 forme alotropice. „Multe fete“ de fosfor pot, totuși, să fie redusă la trei tipuri principale: alb, roșu și negru.
Cea mai frecventă modificare este fosfor alb - ceros incolor și substanță foarte toxică, cu tplav = 44.1 ° C Punct de fierbere și = 280 ° C În apă, este practic insolubil, dar vaporii de apă este destul de ușor pentru a da un amestec gazos. Este solubil în uleiuri eterice, benzen, terebentină și grase, dar cel mai bun din disulfură de carbon. Calcinată prin frecare, deci se taie în bucăți numai sub apă. În întuneric, lit. Prelungit g încălzire (250 ° C), fosfor alb devine roșu.
* Red fosfor - o pulbere de culoare roșu-brun, este absolut inofensiv. Mai puțin activ decât fosfor alb, insolubil în apă, și sulfura de carbon, ea strălucește în întuneric. Reprezintă un amestec de câteva modificări alotropice care diferă de culoare (de la purpuriu la purpuriu) și alte proprietăți.
^ Fosfor negru - forma cea mai stabilă a elementului. Prin aspectul lor se aseamănă din metal: fier are o culoare coloratie, are un luciu metalic are metalliches conductivitate electrică Coy, duritatea și conductivitatea termică. În numele formelor active solide de fosfor elementar. lui
puteți să-l taie în aer, ca și în cazul în care să dea foc la un meci, fosforul negru se aprinde cu dificultate.
Se pare alb fosfor încălzire prelungită la 200 ° C și o presiune de 1200 MPa.
Proprietăți alotropice modificări ale fosforului sunt explicate prin structura lor. A studiat mai în detaliu structura fosforului alb. Are un grilaj molecular. Molek His-ly chetyrehatomny (P4 - tetraphosphorus) și au piramida triedru în formă corectă clorhidric.
Fiecare atom de fosfor este într-una dintre nodurile piramidei și este legată de trei pi legături cu alți trei atomi. fosfor roșu și negru sunt poliatomic rețea cristalină.
atomi de fosfor pot fi combinate în molecule P2. P4 și substanțe polimerice.
Activitatea fosfor chimică semnificativ mai mare decât cea a azotului.
Fosforul este oxidat cu oxigen: oxigen în exces de oxid de razuetsya de fosfor (V), iar deficitul - oxid de fosfor (III):
În reacția de oxidare este însoțit de ea emițătoare de aer, adică Chemiluminiscentei are loc (emisie de lumină în reacții chimice).
Fosforul reacționează cu multe substanțe simplu E - halogeni, sulf și unele metale, și care prezintă oxidarea și reducerea proprietăților. Compuși phos-numite fosfuri metalice handicap.
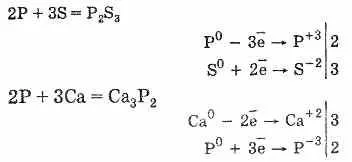
Fosforul furnizează compuși și elemente de grup de tranziție cu același grup de V: VP, VP2. NBP, NbP2. Se pune, TAP2.
oxidanți puternic fosfor transformat în acid fosforic:
Reacția dintre fosfor alb sunt mai bune decât roșu.
Fosforul în condiții normale nu reacționează cu hidrogen, deci compus de fosfor cu hidrogen - fosfin - se obțin fie prin reacție cu alcalii fosfor:
P4 3KON 3H2O = PH3 3KN2 PO2 sau fosfuri prin reacția cu apă:
Fosfină PH3 - gaz incolor cu miros de „pește putred“. Este toxic, inflamabil în aer și pot forma amestecuri explozive, în anumite condiții de separare condiți. Fosfină TION la temperaturi obișnuite, nu se descompune, dar la temperaturi ridicate și în absența oxigenului dezintegrare are loc într-o măsură apreciabilă:
Slab solubil în apă: 1 volum de fosfină dizolvat în 4 volume de apă. Cunoscute cristaline foarte instabile phos-final PH3 • H2 O, hidroxid de compoziție corespunzătoare pH 4 OH, -od proprietăți de bază Nako pentru acest compus nr.
Sărurile fosfinici cu structură similară cu sărurile de amoniu, vărsarea în interacțiune formează o soluție puternică de acizi de hidrogen cu fosfina gazos. Comparativ cu săruri de amoniu sunt mai puțin stabile.
PH 4 SlO4 fosfoniu perclorat exploziv, halogenuri și se descompun complet la încălzire: PH3 = CI pH 4 cu HCI
La anumite raporturi de oxigen și PH3 autoignites amestec:
Fosfină - unul dintre cei mai puternici agenți de reducere. El Regenera săruri metalice navlivaet în soluție la fosfuri și, în unele cazuri, la metale:
Deoarece halogenuri de fosfor fosfină reacționează pentru a elibera fosfor liberă medie:
fosfor roșu este utilizat în industria de meci. fosfor roșu, sulfură de antimoniu (III), oxid roșu de fer (oxid naturale de fier (III) cu un adaos de cuarț) și lipici-sfeterisi se prepară din amestec, care se aplică pe suprafețele laterale ale cutiei irecuperabile spin. se potrivește cu capul constă în principal din potasiu clorit-rata, rodat și lipici. Prin frecarea capului se extinde Matchbox de fosfor roșu care se aprinde, aprinde o parte a capului, și prin arborele său lumini.
fosfor alb are o largă aplicare. De obicei, este folosit pentru a produce ecrane de fum. fosfor negru la schimbare foarte rar.
^ 6.2. oxizi de fosfor (III) și (V)
Fosforul formează un număr de oxizi, dintre care cele mai studiate și importante din punct de vedere practic, oxid de fosfor (III) P2 O3 și oxid de fosfor (V) P2 O5.
oxizi de fosfor (III) și (V) au o trăsătură comună. La determinarea formulei lor adevărat dovedit că au fost chiar și în perechi sunt dimeri. Formulele lor ar trebui să fie scris după cum urmează: P4 și P4 O10 O6. Motivul apariției unei astfel oarecum neobișnuită structură formarea de temperatură unii cercetători se străduiesc vezi-SRI fosfor menține structura moleculei P4 și mai departe, pentru a forma un tetraedru, în centrul căruia a fost localizat la atomul de fosfor și atomii de oxigen la colțuri. Acest tip de structură diferă rezistență etsya mai mare și este stocat într-o continuare stabil O-acizi ai fosforului și fosfați.
^ Oxid de fosfor (III) P2 O3 (P4 O6) - Ceska ceros masă cristalină, care se topește la 23,8 ° C, ușor solubil în solvenți organici-nical. Foarte toxic. Obținută prin arderea fosforului în condiții de oxigen limitat:
Prin proprietățile chimice P2 O3 este acid hidroxi-house prin reacția cu apă la temperatura camerei forme de acid fosforos:
Dar de căldură suficient de mici pentru a-hidrat în loc TION a fost de proces redox:
Reacția cu formele de săruri alcaline: 4NaOH P2 O3 = 2Na2 HPO3 H2O
oxid de fosfor (III) posedă proprietăți regenerative mi: oxidat cu oxigen la P2 O5. P2 O3 O2 = P2 O5
^ Oxid de fosfor (V) P2 O5 (P4 O10) - alb-higro pulbere skopichny friabilă, vrac până pufos. S-a obținut prin primul-reniu cu fosfor în exces de aer sau oxigen:
Foarte reacționează energic cu apă pentru a forma un acid butiric fosfor:
Această caracteristică a P2 O5 vă permite să-l utilizați utilizat pe scară largă ca un agent de deshidratare eficient.
Acesta este capabil de a converti acidul sulfuric și oxid nitric în:
Cu oxizi de bază reacționează numai cu fuziune:
Reacționează cu baze:
^ 6.3. Orto-, meta- și acid pirofosforic. ortofosfat
oxid de fosfor (V) P2 O5. interactioneaza cu apa, formele NRO3 de acid metafosforic; acestea din urmă se formează în timpul de fierbere
^ Tabelul 23. Acid fosforic
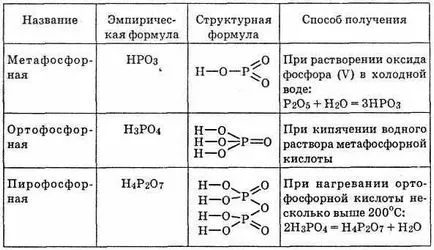
Acid ortofosforic H3 PO4; prin încălzirea difosforic format H3 PO4 (sau pirofosforic) Acid H4 P2 O7 (vezi. Tabelul. 23).
acidul metafosforic și este instabil în forma sa pură nu te-tributed precum și soluții nu sunt izolate din sarea sa. Poate exista ca un polimer (NRO3) n. Mai mult posibil mac macromolecule, pornind de la gradul de polimerizare n = 3. Acid metaphos-Forneys este foarte puternică, toți ionii de hidrogen în aceasta disociere a e-lea. Cu toate acestea, ele nu sunt specifice pentru orice oxidare sau reducere a calității. Acid metafosforic macromolecula Apă scindat H3 PO4.
Astfel, acizii metafosforici sunt instabile și pre-resents o etapă de reacție-TION oxid doar intermediar hidrat de fosfor (V) P2 O5.
^ Acid fosforic H3 PO4 - cel mai stabil din tot acidul de fosfor pentavalent. Este o substanță fuzibil solid cristalin incolor. cristal-LY său transforma într-o masă siropoase în aer. Non-toxic-ta. Deoarece apa este amestecat în orice proporții. La temperaturi normale, inerte, nu se reface cărbune și chiar vodoro-house. Acesta nu a arătat proprietăți oxidante sau reducătoare. Dar când este încălzit reacționează cu metalele și oxizii lor, acționează asupra cuarțului și chiar aurul.
Deoarece are o putere medie de acid. Exercită proprietățile sale pis lotnye atunci când interacționează cu alcalii:
In industrie, acidul ortofosforic a fost preparat prin două metode: extracție și termică. În prima metodă de fosfat de calciu maruntita este tratată cu acid sulfuric:
CaSO4 precipită ca un precipitat și acidul rămâne în soluție. Astfel, în soluția acidă se deplasează multe impurități - sulfații de fier, aluminiu. Acest acid este în producția de îngrășăminte.
În a doua metodă, mai întâi, fosfor (-recov niem fosfați naturali). Apoi a oxidat la P4 O10. și pos-Lednev interactioneaza cu apa. Acid pur Recoltat (concentrație 80%).
Molecula de acid ortofosforic de atomi de hidrogen conectat cu un atomi de oxigen-HN:
În soluție apoasă, acid ortofosforic suferă de disociere stu tipic răspuns pas:
Etapa III: N HPO 4 2- 3- 4 PO
I domină de obicei etapa de disociere. Fiind un tribazic, se formează o sare - ortofosfat trei tipuri:
1) fosfat - toți atomii de hidrogen din acidul fosforic (K3 PO4 (NH4.) 3 PO4) substituit;
2) hydrogenphosphates - substituit cu doi atomi de hidrogen de acid (NRO4 K2 (NH4.) 2 HPO4);
3) dihidrogenfosfat - substituit un atom de hidrogen al acidului (KH2 PO4 NH4 H2 PO4) ..
Toți fosfați ai metalelor alcaline și amoniu sunt solubile în apă. Deoarece sărurile de calciu ale acidului fosforic dizolvate în apă numai Ca (H2 PO4) 2 - ortofosfat monobazic. fosfat acid de calciu CaHPO 4 și fosfat de calciu Ca3 (PO4) 2 sunt solubile în acizi organici.
Săruri ale acidului ortofosforic sunt îngrășământ valoroase.
Superfosfat - un amestec de CaSO4 și Ca (H2 PO4) 2 • H2O Pentru obținerea depunerilor de superfosfat fosforit naturale tratate cu acid sulfuric:
^ Superfosfate dublă Ca (H2 PO4) 2 este preparat prin acțiunea fosfatului de calciu natural phos-Forneys Acid:
CaHPO precipitat 4 • 2H2O este insolubil în apă, dar este etsya solubil în soluri acide. utilizare precipitat net în QUALITY Island fosfornoizvestkovoy aditiv pentru hrana vitelor. Preparat din hidroxid de calciu:
Ammofos - un amestec de NH4 H2 PO4 și (NH4) 2 HPO4 - îngrășământ valoros set care conține azot și fosfor. Preparat prin reacția am Miaka cu acid fosforic.
dihidrogen fosfat de sodiu NaH2 PO4 utilizat în medicină.
^ Pirofosforic acidului H4 P2 O7 este o masă moale sticlos (punct de topire = 61 ° C), ușor solubil în apă. lot Kis-tetrabazic și este mai puternic decât fosforic.
^ 6.4. Esterii acidului fosforic
Literatura de specialitate descrie un mare număr de derivați ai pro-organici ai acidului fosforic. Acest Esteri lor mol-kuls constau dintr-un radical și un anion al unui acid organic cu fosfor alcool. Unele dintre ele sunt extrem de importante pentru organism. De exemplu, fosfați de zaharuri:
sau derivați ai acidului fosforic și glicerol:
esteri fosforici ai zaharurilor joacă un rol important în fotosinteză-se și metabolismul și acizii glicerofosforic participă la transformarea grăsimii.
Compușii care constau din reziduuri ale celor doi acizi și Interac care acționează cu acidul care formează apa menționată favorabile IMM-urilor
anhidrida shannym. există o astfel de anhidridă de acid acetic și fosforic:
Comunicați ușor de spart între ele. Un proces similar are loc în natură în sinteza proteinelor.
Cele două cele mai importante pentru viata de acid organism - DNA (dezoxiribonucleic) și ARN (ribonucleic) - pre-resents un lanț lung, răsucite în spirală și co-standing alternante grupuri de carbohidrați și fosfat. Hidroliza acestor acizi se descompun în lanțuri carbohidrat fosfat separate.
Un alt fel de important de importanta biologic Conn-Neny sunt fosforproteidy. Un reprezentant al acestui tip de co-unitate - cazeinei este principala parte de brânză de vaci și brânză.
Înțeles molecule organofosforici pentru forme de viață terestre exclusiv. Pe baza acestora, a făcut nevoie de mai-„mașini biologice“ toată lucrarea corpului. Secretul constă etsya conținut energetic ridicat de legăturile fosfat P-O. Koh da în adenosinetriphosphate scindată sub acțiunea moleculei de apă de H3 PO4. se ridică aproximativ 50000 kJ (per 1 mol). Departamentul de moleculă H3 PO4. SINGLE-adăugire la o moleculă de organo-substanta-etnic, Prien sită cu o legătură bogată în energie. O astfel de structură este mai ușor să intre organofosforic parte de transformare-chi nomice - este mai mult activitatea. Astfel, comunicarea-bo-gatye energie poate transforma-schatsya de la o moleculă la alta, și furnizează energia pentru toate celulele corpului (vezi. Fig. 21).
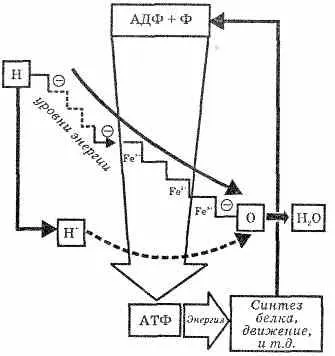
Figura 21. Schema de conversie adenozin-trifosforic (ATP) și acizii adenozin difosfat (ADP), în organism.