Valența diferitelor stări de oxidare, ceea ce este diferența
Valenței și oxidarea de stat - noțiunea, adesea utilizată în chimia anorganică. În mulți compuși chimici valoare de valență și gradul de oxidare a elementului sunt aceleași, pentru acest motiv, elevii și studenții este de multe ori confuzie. Aceste concepte nu au ceva în comun, dar diferențele sunt mai semnificative. Pentru a înțelege ce este diferența dintre aceste două concepte, este necesar să se cunoască mai multe despre ele.
Datele privind gradul de oxidare
Gradul de oxidare - valoarea auxiliară atribuită atomului chimic element sau grup de atomi, care arată modul în care perechea de electroni distribuite partajat între elementele cooperante.
Această valoare auxiliară, care nu are nici o semnificație fizică în sine. Esența ei este destul de simplu pentru a explica prin exemple:
Sare molecula comestibile NaCl este compus din doi atomi, - un atom de clor și un atom de sodiu. Relația dintre acești atomi ion. In cel de sodiu nivel de valență de electroni 1, înseamnă un atom de clor, o pereche de electroni comun. Din aceste două elemente de clor mai electronegative (are proprietatea de a se amesteca perechilor de electroni), singura pereche comună de electroni schimbare la aceasta. In compusul elementului cu elektrotritsatelnostyu superior are o stare de oxidare negativă mai puțin electronegative, respectiv, pozitivă și valoarea sa este egală cu numărul de perechi de electroni partajate. Pentru molecula gradul NaCl de oxidare de clorură de sodiu și se va arăta astfel:
Clor, cu un offset la acesta electroni pereche, acum considerată ca un anion, adică un atom atașat la el însuși de electroni în plus, și de sodiu - ca un cation, adică un atom donor de electroni. Cu toate acestea, atunci când se înregistrează gradul de oxidare, în primul rând, există un semn, iar a doua valoare numerică, în timp ce înregistrați taxa ionic - dimpotrivă.
Oxidarea poate fi definit ca numărul de electroni care ionul pozitiv nu este suficient pentru atomi neutri electric sau care au nevoie să ia departe de ionul negativ la oxida atomului. În acest exemplu, este evident că ionul pozitiv de sodiu prin deplasarea perechii de electroni unui electron lipseste, iar clorul ionic excesul de un electron.
Material simplu grad de oxidare (grad), indiferent de proprietățile sale fizice și chimice, este zero. molecula O2. de exemplu, este format din doi atomi de oxigen. Ei au aceleași valori electronegativitate, deoarece comune electronii nu se mișcă la oricare dintre ele. Prin urmare, perechea de electroni este strict între atomii, deoarece gradul de oxidare va fi zero.
poate fi dificil pentru unele dintre moleculele determina unde muta electroni, în special în cazul în care elementele din ea trei sau mai multe. Pentru a calcula gradul de oxidare a acestor molecule, este necesar să se utilizeze câteva reguli simple:
- Atomul de hidrogen este aproape întotdeauna are o stare de oxidare constantă +1 ..
- Pentru oxigen, această cifră este -2. Excepțiile de la această regulă sunt doar oxizi de fluor
Deoarece fluor - element de electronegativitate cu mare, pentru că întotdeauna se mută de a se electroni care interacționează. În conformitate cu normele internaționale, un membru elektrootritsaelnosti valoare mai mică este scris în primul rând, pentru că în acești oxizi de oxigen, în primul rând.
- Dacă adăugați la toate gradele de oxidare a moleculei, veți obține zero.
- Pentru atomii de metal tipic stare de oxidare pozitivă.
La calcularea gradelor de oxidare trebuie amintit că gradul maxim de oxidare a elementului este egal cu numărul grupului său, iar cea minimă - numărul grupului minus 8. valoarea maximă de clor posibilă a stării de oxidare +7, deoarece este în grupa a 7-a, iar cea minimă = 7-8 -1.
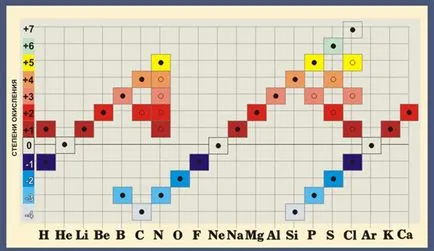
Informații generale despre valența
Valenței - numărul de legături covalente, care pot forma un element în compuși diferiți.
Spre deosebire de starea de oxidare, conceptul de valență are o semnificație fizică reală.
Cea mai înaltă rată este egală cu valența numărul grupului în tabelul periodic. Sulful S este situat în al doilea grup, adică valența maximă 6. Dar poate fi, de asemenea, 2 (H2S) sau 4 (SO2).
Aproape toate elementele caracteristice ale valență variabilă. Cu toate acestea, există atomi, pentru care această valoare este constantă. Acestea includ metale alcaline, argint, hidrogen (valență lor sunt întotdeauna egale cu 1), zinc (valența întotdeauna 2), lantan (valență este 3).
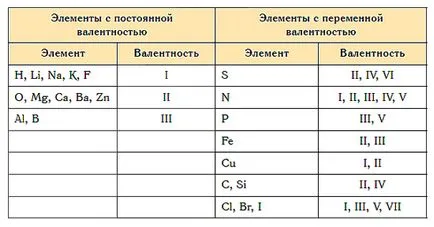
Ce este comun între valență și starea de oxidare
- Pentru a identifica și una și celelalte valori sunt utilizate numere întregi pozitive care sunt scrise într-un element de simbol latin.
- Cea mai înaltă valența ca cea mai mare stare de oxidare, coincide cu numărul membrului grupului.
- Starea de oxidare a oricărui element din compusul complex coincide cu valoarea numerică a unuia dintre valența indicatori. De exemplu, clorul fiind gruparea a 7 poate avea o valență de 1, 3, 4, 5, 6 sau 7, atunci este posibil oxidare ± 1 + 3, + 4, + 5, + 6, + 7.
Principalele diferențe dintre aceste concepte
- În conceptul de „valență“ un sens fizic, iar gradul de oxidare - un termen auxiliar are nici un sens fizic real.
- Oxidarea poate fi zero, este mai mare sau mai mică decât zero. Valența este strict mai mare decât zero.
- Valenței afișează numărul de legături covalente, și gradul de oxidare - distribuția electronilor în compus.