Subiect №3 cinetică «de reacții chimice“
Moleculele active și energia de activare. Clasificarea Kinetic proceselor chimice.
viteza de reactie chimica omogena si metode pentru reglarea acestuia (dependent de concentrație, presiune). Legea acțiunii de masă. Răspunsul vibrațională.
Dependența vitezei de reacție la temperatură. regula Van't Hoff. ecuația Arrhenius.
Dependența vitezei de reacție a catalizatorului. Cataliza. cataliza omogenă și eterogenă. Mecanismul de acțiune a catalizatorilor. Catalizatori și sisteme catalitice.
Starea de echilibru chimic. Cinetica reacțiilor eterogene. Efectul concentrației, presiunii și temperaturii asupra ratei reacțiilor eterogene. echilibru eterogeni.
Faza de echilibru. Conceptul de fază. componente dependente și independente. faze Gibbs Rule-Konovalova. Gradul de libertate și variabilitate a sistemului.
Toate procesele chimice observate în natură și efectuate de către o persoană în activitățile sale practice au loc în timp, la o anumită rată. adâncimea de focalizare și transformările chimice dictate de legile termodinamicii. Cu toate acestea, analiza termodinamică a proceselor chimice nu răspunde la întrebările despre viteza cu care și prin care etapa intermediară, sistemul a fost mutat de la inițială la starea finală. Timpul reacției chimice este subiectul cinetica chimică.
cineticii chimice cu termodinamica este baza teoretică a tehnologiei chimice, din moment ce Acesta permite de a intensifica și de a optimiza reacțiile importante punct de vedere comercial.
Posibilitatea teoretică a reacției chimice nu înseamnă că este în realitate. Un exemplu clasic este oxidarea substanțelor organice, care sunt termodinamic posibile, chiar și la temperaturi scăzute. În cazul în care aceste procese au loc la o rată apreciabilă în condiții ambientale normale, nu ar fi posibilă însăși existența organismelor vii.
De exemplu, calculele termodinamice arată că hidrogenul și clor în condiții standard trebuie să reacționeze în mod spontan, ceea ce conduce la formarea de acid clorhidric. În realitate, un amestec al acestor gaze pot fi stocate în întuneric pentru o lungă perioadă de timp și nici un semn de interacțiune chimică, noi nu găsim. Dacă amestecul de reacție la ultraviolete lumina va avea loc instantaneu și complet.
Un alt exemplu al probabilității termodinamic al reacției de oxidare a hidrogenului la apă:
H2 + ½ O2 = H2O (g)
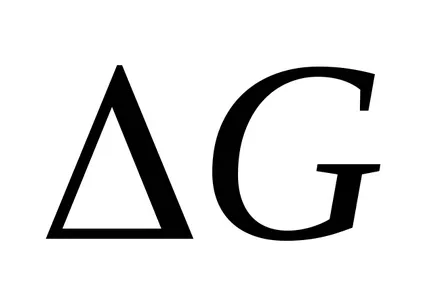
semnificativ mai mare decât probabilitatea reacției de neutralizare a apei, pentru a forma:
H ++ OH- = H2O (g)

În același timp, prima reacție în condiții normale, cu greu au loc fără catalizator, iar al doilea are loc aproape instantaneu.
Cinetică chimică - o secțiune a chimiei care studiază mecanismele și ratele de procese chimice.
Întrebarea 1. Activitatea moleculei și energia de activare
Deoarece reacția chimică - este procesul prin care ruptura legăturilor chimice existente și formarea unora noi. Aceasta este de a pune în aplicare un astfel de proces ar trebui să:
Coliziunea reacționează particule (atomi, molecule sau ioni);
Prezența acestor particule de rezervă de energie suficientă;
Poziția optimă a particulei în raport cu celălalt în spațiu.
Ciocnirea a două sau mai multe particule având o energie suficient de mare, permite depășirea repulsia reciprocă a electronilor și pentru a asigura gradul necesar de interacțiune de contact. În acest caz, se produce o reacție chimică.
Viteza de reacție a fost determinată de numărul de coliziuni (actele de reacție elementare) care provoacă o conversie chimică pe unitate de volum per unitate de timp.
Cu toate acestea, nu fiecare coliziune rezultate din interacțiunea chimică a moleculelor. Să ne gândim. 1 mol de orice gaz ocupă un volum la STP 22,4l, care conținea 6,02. 23 octombrie molecule. Astfel, 1 cm3 de gaz conținut

astfel Viteza de reacție este determinată nu de numărul de coliziuni comune pe unitatea de timp, iar numărul de coliziuni molecule active. molecula activă - o moleculă având un conținut crescut de energie în comparație cu energia medie a moleculelor aceleași substanțe. Diferența dintre rezerva de energie a moleculelor active și energia medie a moleculelor acestei specii în aceste condiții se numește energia de activare. astfel EAKT energie de activare. (J / mol) este cantitatea de energie care trebuie raportată la molecula cu o medie de energie stocată pentru a face molecula activă pentru reacție.
Calculele teoretice ale lui Maxwell și Boltzmann (1880) a arătat că, la un anumit molecule de gaz de temperatură asupra vitezei lor (și, prin urmare, energia cinetică) sunt distribuite într-un anumit fel, distribuția nu se modifică în timp, în ciuda faptului că fiecare moleculă de individ se schimbă continuu viteza (legea distribuției Maxwell-Boltzmann).
Conform acestei legi, există întotdeauna molecule cu energie suficient de mare pentru a depăși bariera de energie.
Figura 1. T1, T2, T3 trei temperaturi diferite; E este energia de activare, iar zona umbrită caracterizează numărul de molecule active. Odată cu creșterea curbei de distribuție a temperaturii deplasează spre dreapta, și crește semnificativ proporția de molecule active și viteza de reacție chimică, de asemenea, crește.
Mecanismul reacției chimice pot fi reprezentate grafic, în cazul în care energia ordonata a sistemului, iar pe abscisă - reacția (Fig.2).
Dacă reacția înainte (adică, tranziția de la starea I să precizeze II) este exotermă, alimentarea cu energie totală a produșilor de reacție mai mică decât materiile prime, iar sistemul ca rezultat al acestei reacții continuă la un nivel mai redus de energie. Diferența de nivel I și II este egal cu efectul termic al reacției

Moleculele activatoare poate avea loc nu numai prin creșterea temperaturii, dar, de asemenea, sub influența energiei radiante, descărcări electrice, valuri de ultrasunete, radiații ionizante.