Structura și proprietățile proteinelor
Printre biopolimeri complexe privind valoarea funcțională și raportul calitativ coli joaca un important rol de proteine. In celulele animale, ele constituie 40-50% din greutatea uscată în plantă - 20-- 35%. O varietate mare de ființe vii este diferențe în compoziția proteinelor fisionabil definite în mare măsură. Numai în corpul uman există mai mult de 5 milioane de tipuri. Motivul pentru acest lucru este explicat varietate de proteine din stroeniya.Belki specifice ale acestora sunt polimeri ai căror monomeri yavlyayutsyaaminokisloty. Este cunoscut de 20 de tipuri de aminoacizi care formeaza moleculele de proteine Ele sunt numite o novnymi pentru a se distinge de alți aminoacizi sunt de asemenea prezente în organism, dar nu face parte din moleculele proteice. Toți acești aminoacizi în moleculele lor au aceeași structură de atomi
N-C-COOH, unde COOH - grupare carboxil, o -NH2 -
A patra valență legătură carbon este ocupată de așa-numitele resturi Radick (R). Radicali de diferite tipuri de aminoacizi diferă una de cealaltă, în structura chimică, sarcini electrice precum și capacitatea de ra-stvoryatsya în apă. Aminoacizii sunt compuși amfoterici, adică. E., același aminoacid poate servi atât ca acid și ca alcaline. Proprietățile acide se împarte gruparea carboxil (COOH) și alcalină - gruparea amino (NH2). Datorita aminoacizilor amfoteri pot interacționa unul cu celălalt, dintre care unul acționează ca acid, iar celălalt - ca alcalin; un grup carboxil aminokis loturi reacționează cu un alt grup amino). Compus de aminoacizi într-un rinichi de proteine efectuat datorită legăturilor covalente puternice. Acest proces poate fi scris folosind această ecuație:
Compusul rezultat de aminoacizi numită o peptidă, o legătură covalentă între ele - o legătură peptidică. Toate proteinele sunt polipeptide t. E. Lanțul alcătuit din mai multe zeci sau chiar sute de unități de aminoacizi. Dintre cele 20 de tipuri de aminoacizi pot construi cantitatea de proteine-ing căpcăun, la fel ca din cele 20 de litere ale alfabetului poate fi ridicat, a construi un set de cuvinte al căror sens va depinde, de orice scrisori în care sunt făcute, cât de mult pentru a lua și în ce ordine sunt stabilite. Proprietățile moleculei de proteină definită amino compoziție acidă, numărul de unități de aminoacizi, precum și succesiunea lor în ordinea de lanț.
Secvența de resturi de aminoacizi din molecula de proteină definită fisionabil egopervichnuyu-structură (Fig. 1 I). Având în vedere că dimensiunea un nivel de aminoacizi a doua este de 0,35-0,37 nm, este evident că moleculele macromoleculei de proteine care constau din sute de resturi de aminoacizi, ar trebui să aibă o lungime de cateva zeci de nanometri. De fapt, aceleași dimensiuni proteine STI spațiu mult mai mici deoarece lanțul poli-peptidic este răsucit complet sau parțial într-o spirală, care pre-stavlyaet structura soboyvtorichnuyu a proteinei (Fig. 1-II). Radicalii de aminoacizi sunt deci în afara helix, și între NH-grupurile prezente pe o bobină, și CO grupurile asupra spirelor adiacente ale legăturilor de hidrogen helix formate. Ele sunt mult mai slabe decât covalentă, dar a repetat de mai multe ori, da o legătură puternică. helix Poly-peptidă „cusute“ prin numeroase legături de hidrogen este o structură destul de solidă. Polipeptida este stivuire în continuare în spirală - se pliaza complicat, pentru fiecare proteine, dar destul de sigur și în mod constant într-o așa numită Globo-lu (bulb), care reprezintă soboytretichnuyu structura moleculei de proteină (Fig 1-III.).
Structura terțiară a proteinei este menținută conexiunile de trei tipuri: E-Ionny, hidrogen și disulfurice și interacțiune hidrofobă-conse-. Cantitativ, cele mai importante sunt hidrofobe reciproc imootnosheniya: în mediu apos celula radicali hidrofobi, se resping reciproc. Astfel, mediul apos deoarece forțează molecula de proteină să adopte o anumită structură ordonată, care este activă biologic.
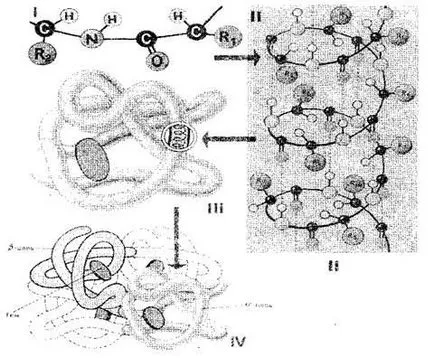
Fig. 1. Structura schematică a celulelor proteice: I, II, III, IV - structura primară, secundară, terțiară și cuaternară
Proteinele sunt compuse dintr-un singur lanț polipeptidic, au doar structura terțiară. Cu toate acestea, unele proteine sunt construite din mai multe lanțuri polipeptidice. Pentru a le pune ponyatiechetvertichnoy structura (Fig. 1-IV), care este o unitate funcțională de hold-legat atât prin interacțiuni hidrofobe și legături de hidrogen și legături ionice. Structura cuaternară se caracterizează, de exemplu, pentru hemoglobina. molecula este format din patru lanțuri de polipeptide separate. Unii viruși, cum ar fi virusul mozaic de tutun, un strat proteic format din lanțuri polipeptidice cu multe yaschuyu de manieră foarte ambalate.
Sub influența diferiților factori fizici și chimici (con de acțiune centrate de acizi și baze, metale grele, la temperaturi ridicate, și așa mai departe. N.) Structura și deci proprietățile moleculelor de proteină poate varia. Tulburări de proces structura naturală a unui lanț de proteină sau polipeptidă desfășoară fără a perturba legăturile peptidice numite proteina Denaturarea (Fig. 2). Ca regulă, Denaturarea este ireversibil, cu toate acestea, în stadii incipiente, cu condiția ca suspendarea factorilor negativi, proteina poate restaura structura sa inițială - un proces numit proteina refolding. Procesul de distrugere a structurii primare a proteinei este întotdeauna inversabilă, aceasta se numește degradarea proteinei.
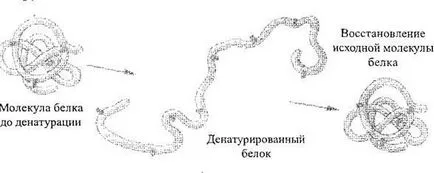
Fig. 2. Diagrama procesului de denaturarea proteinei
Proprietățile fizice și chimice ale proteinelor sunt foarte diverse: susche-există proteine hidrofile și hidrofobe, unele dintre ele sunt ușor de a schimba structura lor, ca urmare a unui minor chiar și factorii de mediu de impact, iar altele sunt rezistente la acest factor-Tori. Proprietățile fizico-chimice ale proteinelor pot fi simple (pro-Thein) și complex (proteid).
Proteinele simple constau exclusiv din resturile de aminoacizi de aceeași îngrămădite-LARG includ compuși de altă natură, cum ar fi viespi și a resturilor fosforici de acizi nucleici, glucide, lipide si altele.
funcțiilor biologice ale proteinelor sunt extrem de diverse. În primul rând, ei vypolnyayutstroitelnuyu funcție. Proteinele sunt o parte integranta a membranelor celulare, care constau din astfel de celule organite non-membranare ca microtubuli și microfilamente, celulele care constituie scheletul (citoscheletului). Dintre proteinele care au puterea si elasticitatea constând Yat-cartilaj, tendon, ligament. De durabile și insolubile cuie proteine cheratină construite, pene. In plus fata de construcție, proteinele au de asemenea o funcție de protecție, adică în prevenirea vătămați-tiile de celule, organe și un organism ca un întreg, și în protejarea organismului de la razit pas și proteine străine. In corpul vertebratelor format proteină protectoare - anticorp. Acestea sunt proteine specializate, Koto-secară limfocite din sânge produse. Ei sunt capabili să „recunoască“ și neutraliza bacterii, virusuri, proteine străine organismului. proteină din sânge fibrinei coagulare provoacă, protejarea organismului împotriva pierderii de sânge durere-Shih.
Funcția de reglementare a proteinelor este capacitatea activității metabolice reglare vat folosind natura proteinelor hormonilor, precum și enzime proteice. Proteinele indeplinesc isignalnuyu funcția. Este abilitatea de a separa proteinele complexe aparținând membranei celulare, „recunosc“ cuplate chimic-TION specifică și un anumit mod de a răspunde la acestea: bind-le, schimba structura lor de a transmite semnale prezența acestor substanțe în alte părți ale membranei sau în celulă. Prin semnalizare funcția de bel-ing, celula poate absorbi selectiv substanțele din mediul extern.
Funcția motorie a proteinelor este abilitatea unora dintre ele să se micșoreze, permițând astfel celula, țesutul, organismul în ansamblu pentru a schimba forma pentru a muta. Astfel, datorită unei astfel de-ing alb ca actină și miozină, fac parte din celulele musculare, scurtarea fibrei musculare; turbulin proteinei din care constau mikrotruboch Set și microfilamente asigură mișcarea cililor și flagelilor celulelor eucariote.
Unele proteine pot fi depuse de către celulă ca rezervă, îndeplinind astfel funcția samymzapasayuschuyu.
În endospermului semințelor multor specii de plante (grâu, porumb, orez) este o proteina care se hrănește embrionul în primele stadii ale dezvoltării sale. Funcția acestor proteine poate fi determinată kakpitatelnuyu.
Proteinele care pot osuschestvlyattransport anumite substanțe din celule sau in interiorul corpului. De exemplu, oamenii și proteine de vertebrate din sange hemoglobina transporta oxigenul de la plamani la celule, și dioxid de carbon - în direcția opusă.
Funcția energetică a proteinelor este ca atunci cand divizarea-SRI in energia celulei este eliberată. O parte din aminoacizi, care sunt imagini prin scindare, este utilizat pentru biosinteza proteinelor noi, în timp ce-pivot tal - scindată la produsele finale de degradare cu eliberarea de energie-em (cu decolteu plin de 1 g proteină eliberată o medie de 17,2 kJ).
Una dintre principalele funcții ale -fermentativnaya proteine. Enzime - sunt catalizatori biologici sau acceleratoare de reacții chimice, un pro-mers într-un organism viu. După cum se știe, viteza de reacție chimică depinde semnificativ concentrația substanțelor și temperatura ambiantă, la care apar aceste reacții. Dacă considerați că durata de viață a celulei (organism) - o combinație a unui număr foarte mare de reacții de sin-teză și degradare, care alcătuiesc metabolismul, devine pe termen clar rolul imens de enzime în procesele vitale ale organismului la toate nivelele. Doar pentru că enzimele la o temperatură relativ scăzută a corpului și scăzute concentrațiile de substanțe în celule și țesuturi, reacțiile chimice procedează la o viteză suficient de ridicată (reacție enzimatică este de 100-1000 ori mai rapid decât într-un mediu fără enzimă). Activitatea catalitică a enzimei de proteină-Obus nu lavlivaet întreaga moleculă, ci doar o mică parte, numit centru de NYM activ. Structura spațială a centrului activ ca cheia vice-ku se potrivește cu forma structura spațială a materialului catalizate (substrat), aceasta explică specificitatea proteinelor enzimatice (Fig. 3).
Când Denaturarea unei molecule de proteină a structurii site-ului activ este perturbat, iar enzima își pierde capacitatea catalitică. Astfel, proteina-enzima catalază, poate influența reacția de scindare, portly în peroxid (H2 O2) la oxigen și apă își pierde sale catalitice ak-getică după expunerea la temperaturi ridicate. De aceea, o picătură de peroxid de hidrogen aplicat felia de cartof crud conține un număr mare de zhaschego-catalază, „fierbe“, iar CARTOF fierte les - rămâne neschimbat.
Proteine, enzime, provoacă reacții chimice în sine, în același timp, rămân neschimbate, ele sunt, uneori, în comparație cu un ac, co-Thoraya care unește cele două bucăți de material textil, în sine, cu toate acestea, rămâne fără măsurabilă-neniya.
Enzimele sunt aranjate într-un anumit fel în celulă și corpul ca un întreg. In celula, enzimele sunt adesea asociate cu membranele sale individuale sau cu membrana organite (mitocondrii, plastidele si m. P.). Efectul asupra organismului de medicamente, hormoni, otrăvuri este că acestea pot stimula sau, dimpotrivă, de a inhiba una sau un alt proces enzimatic-TION.
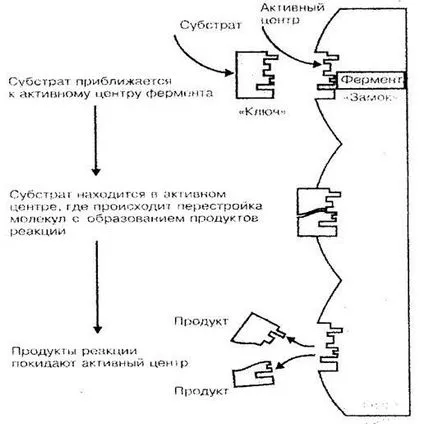
Fig. Schema 3 enzimă de legare la un substrat
Organismele sunt în măsură să reglementeze enzimele biosintezei. Acest lucru face posibilă menținerea constanța relativă a produsului chimic cu obturatorul, indiferent de condițiile de mediu în continuă schimbare.
Laborator № 1