Structura Lecture a d Periodic
Structura Prelegerea a sistemului periodic D. I. Mendeleeva. Grupuri și subgrupuri. Periodice - Pagina №1 / 1
Malyugina OV Curs 4. Structura sistemului periodic DI Mendeleev. Grupuri și subgrupuri.
Sistemul Periodic este format din șapte perioade de zece rânduri și opt grupe, fiecare dintre acestea fiind împărțit în subgrupuri primare și secundare.
Grupul a sistemului periodic al elementelor chimice (PSKHE) - serie verticală a elementelor chimice aranjate în nucleul atomic ascendent încărcare, care sunt aceleași în cele mai înalte compușii lor valența egal cu numărul de grup. Numărul grupului este indicat printr-un numeral roman.
Fig.1. Grupuri PSKHE

De exemplu. atom de sodiu (Z = 11) are cea mai mare valenței I, PSKHE tk situat în grupa I și atomul de clor (Z = 17) - VII, ca Se află în grupul VII.
De exemplu. toate elementele din grupa II au cea mai mare valența II, astfel încât formula de oxizi ai elementelor superioare ale perioadei II în general RO (MgO, CaO, BaO, ZnO, etc.). Toate elementele perioadei IV exponat cea mai mare valență egal IV, astfel formula de oxizi ai elementelor superioare ale perioadei IV în general RO2 (CO2. SiO2. TiO2. GeO2. Etc.).
O excepție este de a lăsa elementele specificate în tabelul 1.
În exemplul de realizare, perioade scurte grupe de sistem periodice sunt împărțite în subgrupe - principale (sau subgrupa A) și lateral (subgrupul B).
Root subgrupă începe cu elementele prima și a doua perioade, partea - cu elemente ale perioadei IV.
Acasă subgrup conține elemente ale ambelor perioade mici și mari. subgrup incidental conține elemente numai pe perioade mari.
Fig. 2. Principalele și subgrupurile din grupa 1
sistemul periodic

Fig. 3. Unele subgrupuri majore PSKHE
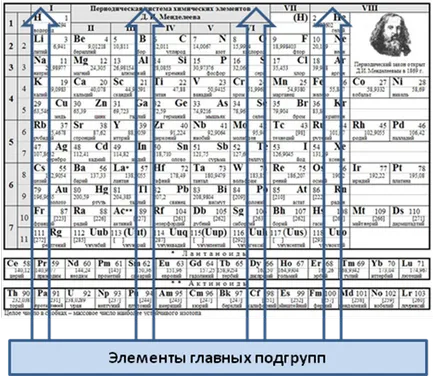
Fig. 4. Unele PSKHE subgrup din partea

În sistemul periodic - 8 și 10 ale principalelor subgrupurile (I - VII grupuri sunt împărțite în două grupe principale - și secundare). grupa VIII este alcătuită din unul principal (gaze inerte) și trei laterale (subgrupul de fier, subgrupa podrguppa cobalt și nichel).
Subgrupul au, de asemenea, numele elementului cu cel mai mic număr de secvență (de obicei, pe un element de a doua perioade de principal și sub-element al perioadei a patra a subgrupurilor).
Elementele inerte sau gazele nobile
Elementele un subgrup au proprietăți chimice similare. deoarece elemente similare fiecare alte subgrupuri pe structura externă a nivelului electronic.
Schimbări regulate observate în principalele subgrupe.
La fiecare subgrup principal în jos este metalic amplificată și proprietăți de atenuare a metaloid, de asemenea, de recuperare îmbunătățită și slăbesc proprietățile oxidante ale elementelor și compușilor formați de aceștia.
Toate elementele podochnyh subgrupuri sunt metale.
Testați-vă cunoștințele
Care sunt elementele structurale este sistemul periodic al elementelor chimice.
Ce este un artist?
Cât de multe grupuri din tabelul periodic al elementelor chimice?
Elementele ce perioade sunt incluse în grupul principal?
Câte subgrupuri în tabelul periodic?
Elementele ce perioade sunt incluse în sub-grupuri?
Câte subdivizate fiecare grup?
Ce face elementele unui grup?
Ce elemente ale unui subgrup?
Cum se schimbă proprietățile elementelor principale de grup de sus în jos?
Ceea ce proprietățile elementelor subgrupurilor?
Care grup conține un primar și trei subgrupuri secundare?
Dintre perioadele, rânduri, grupe și subgrupe.
Group - o serie verticală de elemente chimice aranjate în nucleul atomic ascendent încărcare, care sunt aceleași în cele mai înalte compușii lor valența egal cu numărul de grup.
Opt.
Mici și mari. Acasă subgrup perioadă mică începe elementul (I sau II). A se vedea. Figura 3.
Zece.
Numai mari. Acasă subgrup începe cu perioada elementul IV. A se vedea. Figura 4.
I - VII grup sunt împărțite în două grupe - principal și lateral. grupa VIII constă dintr-unul principal - gaze inerte și trei laterale: subgrupă fier de cobalt subgrupă podrguppa și nichel.
Ca o regulă, mai mare valența elementelor. Este egal cu numărul de grup, care este un element.
Proprietăți chimice, deoarece elemente similare fiecare alte subgrupuri pe structura externă a nivelului electronic.
La fiecare subgrup principal în jos este metalic amplificată și proprietăți de atenuare a metaloid, de asemenea, de recuperare îmbunătățită și slăbesc proprietățile oxidante ale elementelor și compușilor formați de aceștia.
Metal.
A opta.
Ce grup și podruppe sunt elemente cu numere atomice 6, 40, 26, 53, 80? Se specifică caracterul lor, numele rus, masa atomică relativă.
Scrieți numele de caractere, numărul de serie al elementului și masa atomică relativă a elementului, care este: a) în perioada III, subgrupa principal al Grupului VI; b) în perioada V din grupa de tranziție grupa II; c) VI este prezentat, subgrupul principal al grupului IV;
g) în perioada IV, grupa de tranziție grupa VII.
Scrieți caractere, nume și numere de serie ale tuturor elementelor perioadelor mici, care sunt subgrupa principal din grupa IV.
Scrieți caractere, nume și numere de serie ale tuturor elementelor care se află în sub-grupuri de grupa II.
Ce elemente ale subgrupului principal al elementelor Grupa V sunt perioade lungi de timp? Scrie simbolurile lor, numele românești și numere de serie.
Ce element de: bariu sau de calciu este proprietăți metalice mai pronunțate, și de ce?
Ce element de: oxigen sulf sau este proprietăți metalice mai pronunțate, și de ce?
Care element din grupa VII al grupului principal este cel mai activ non-metal? De ce?
Care element din grupa principală Grupa I este metalul cel mai activ? De ce?
În unele grupuri ale sistemului periodic al elementelor sunt toate metalele?
Care grup este doar un non-metal?
În unele grupuri ale sistemului periodic al elementelor sunt toate nemetale?
Scrieți formula oxizi ai elementelor de număr atomic 16, 14, 25, 48, 13, în care aceste elemente au cea mai mare valența.
Scrieți formula oxizi ai elementelor din grupa principală grupa IV, în care acestea au cea mai mare valența.
3. Perioadele mici I - III. Subgrupa principal al elementelor IV grup includ perioade de carbon scurte C (Z = 6) și siliciu Si (Z = 14).
4. Incidentale subgrupul II grupa: Zn zinc (Z = 30), Cd cadmiu (Z = 48) este mercur Hg (Z = 80) A se vedea Fig.4.
5. perioade mari IV - VII. Subgrupa principal al elementelor grupului V sunt perioade mari sunt arsenic As (Z = 33), antimoniu Sb (Z = 51), bismut Bi (Z = 83).
6. Bariu. Bucurându-se de PSKHE. Ele sunt în același grup principal și subgrupa în partea de sus în jos principal există o întărire a proprietăților metalice. Bariu este mai mic decât calciu.
7. oxigen. Bucurându-se de PSKHE. Ele sunt în același grup principal și subgrupa în partea de sus în jos principal există o slăbire a proprietăților nemetalice. Oxigenul este mai mare decât sulf.
8. Fluor. Bucurându-se de PSKHE. Principalul Subgrupul de sus în jos există o slăbire a proprietăților nemetalice. Cel mai activ non-metal este la începutul grupului.
9. Franța. Principalul Subgrupul de sus în jos nu este îmbunătățită proprietăți metalice. Metalul cel mai activ este, la sfârșitul fiecărui grup.
10. I (cu excepția hidrogenului, deoarece poziția sa este ambiguă) și II.
12. Un astfel de grup nu este prezent, deoarece toate grupele laterale conțin elemente de subgrupă și toate subgrupurile - metale.
Urmează PSKHE determină numărul de grup. valență mai mare = numărul de grup.