sticlă alcali-aluminosilicat
sticlă alcali-aluminosilicat. - Secțiunea Chimie, Legătura chimică în pahare, în conformitate cu teoria Aluminiul electron-uri structurale rol (Al) în sticlă Identic rolul său în cristalin.
Rolul structural al aluminiului (Al) în sticla este identic cu rolul său în aluminosilicați cristalini, adică, A1 3+ cationi poate fi într-o coordonare cvadruple sau sextuple de tetraedre de oxigen și de tip formă de coordonare A104 (tetraedre) și A106 (octaedrii).
Condiția existenței aluminiului într-o anumită coordonate de stat Zion în pahare de silicat este raportul dintre concentrația de substanță alcalină (sau alcalino-pământoase) A12 oxizi și oxidul de 03. La rapoarte M2 0 / A12 03> 1 A1 3+ ionii prezenți în sticlă în mediul tetraedric. Trebuie remarcat faptul că gruparea [A104] 5 în pahare de silicat nu există în mod independent. Este stabil numai în cazul în care în apropierea tetraedrul [A104] 5- situat ion de metal alcalin cum ar fi sodiu. Stabil în acest caz, nu este pur și simplu gruparea [A104] 5- un grup de atomi [(A104) 5-Na +] 4-. în care ionul de sodiu nu este con cuplat la orice atom particular oxigen și este localizat pe tetraedrul [A104] 5- compensa parțial sarcina negativă grupărilor anionice.
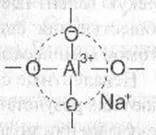
Atomii de oxigen la vârfurile unui A104 tetraedru în acest caz, sunt punți și pot participa la formarea legăturilor chimice cu tetraedre siliciu-oxigen. Ca și în grupul cristalin silicat de aluminiu tetraedrică poate, împreună cu SiO4 tetraedre. să participe la construcția de sticlă cadru structural, este unit cu ei topuri. Form grila mixtă din aluminiu silicat.
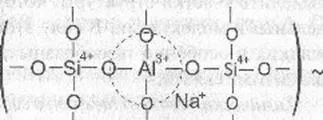
Atunci când este administrat în sticlă alcalină de silicat de alumină crește gradul de conectivitate de rețea structurale, ca acesta este încorporat în cușcă siliciu-oxigen și, împreună cu această schimbare a rolului structural al unei componente alcaline.
Cele mai favorabile condiții pentru depozitele isomorphically înlocuite cu ioni de siliciu la ionii de aluminiu sunt generate în prezența unui nou-cație № +. K +. Ca 2+.
Existența aluminiului în pahare în coordonare șase ori este cel mai probabil în compozițiile alcaline libere și low-alcaline cu tine, expresii naturii acide. cationi alcalinopământoase rază mică de Be 2+. Mg 2+ ajuta la stabilizarea de sticlă alumină, care modificator.
Descriere 9.Valentno-chimică a structurii sticlei.
Legătura chimică dintre atomii apare ca rezultat al electrostatice (Coulomb) interacțiunea dintre electroni și nuclee atomice.
legaturile chimice ale substanțelor pot fi: valență și covalentă. legături valenta tam-tam-cabine rezultă redistribuirea densității de electroni în sistemul atomilor implicați în reacția chimică. Distinge, covalente, donor-acceptor, legături ionice dativ, metalo-ică valență, care diferă una de cealaltă cu privire la gradul de obligațiuni electroni obschestvleniya perechi de atomi sau grupuri de atomi ai unui compus chimic.
Nonvalent comunicare tam-tam-cabină prin interacțiune electrostatică între luni- molecule sau grupări moleculare substanțe. Educația set nonvalence obligațiuni nu este însoțită de transferul de electroni, dar datorită inducției sau NYM dispersie orientational reacționând molecule sau entități moleculare.
Geamul ca în solide cristaline, este imposibil să se aloce porțiuni de structuri care pot fi luate în considerare separat de-molecule. Din acest motiv, în solide, spre deosebire de gazul lichid și, mai ales, domină acțiunea de legături de valență puternice.
10. Legătura chimică în pahare, conform teoriei electronului-urilor.
Conform teoriei clasice de electroni, legătura chimică din sticlă de siliciu este de preferință un covalentă (grad de ionicity de 50%). două tipuri de legături ionice-covalente pot fi distinse în pahare binare de silicat alcalin tip Me2 0-SiO2: predominant atomi covalente în lanțuri
sau mai multe legături ionice între cationii schelet alcalin și anionici, adică tip de conexiune -Me-O-Si-.
Este gradul de caracter ionic - covalency al Si-O. Me-O, nu dorește să creeze un permanent NE-pentru toate tipurile de sticlă, în funcție de compoziția sticlei în ansamblu.
Toate subiectele acestei secțiuni:
Istoria dezvoltării de fabricare a sticlei.
Istoria pictor primul și Indus. producția de fabricarea sticlei pot fi împărțite în mod condiționat în pistă. perioade: perioada 1: mileniu 4-3e BC În societățile primitive primele încercări smelted
Sticla, stare sticloasă.
In natura, toate substanțele și tehnicile pot fi SOST: plasma, gaz, lichid și solid. Solidele pot fi cristaline. sau structura agregatului. Un caz special al amorf de stat-STE
Structura sticlei.
Noțiunea de sticlă ca un sistem complex dispuse și științific fundamentate DI Mendeleev. Potrivit DI Mendeleev, sticla nu are un compus chimic specific considerat de mulți chimiști primele etaje
Descrierea Crystal-chimică a structurii sticlei.
Conceptul baza acestei descrieri sunt ordine rază lungă de mică și în structura substanțelor. comandă cu rază scurtă în general OZNA-chaet amplasarea corectă a atomilor individuali în raport cu o fi
Kvartsevaoe de sticlă.
Unitatea structurală de bază din sticlă de cuarț este siliciu-oxigen tetraedre [SiO4] 4-. Parametrii geo- metric cunoscuți gruparea [SiO4] 4-: distanta Si-O-egal dar 0
Teoria și structura legatura valenta de ochelari.
Această teorie OAPC-doresc să instituie explice formarea grupurilor spațiale focale (poliedre) pe baza caracteristicilor structurale ale atomilor ia în considerare caracteristicile energetice ale orbitalii externe
Teoria Band.
Caracteristici structurale ale zonelor exterioare și natura umplerii electronilor permite clasificarea substanței în izolatul-Brodarea, semiconductori și conductorii, precum și încrederea necesară pentru a arăta-predska optic electric
Vâscozitate.
Vascozitate - cea mai importantă caracteristică și pentru gătit prestabilindu procese produc sticlă, recoacere și călire. Conform legii lui Newton, cu un singur strat de lichid mente cu privire la un alt luat naștere
Doriți să primiți prin e-mail cele mai recente știri?
