șoc toxic Abstract
pneumonie severa, uneori sunt fatale. Moartea se produce de multe ori de insuficiență cardiovasculară acută. boli pulmonare mortal la pacientii cu pneumonie sunt relativ rare.
În aproape toate cazurile cu pneumonie în diferite grade de simptome de intoxicație sunt exprimate. toxemia extremă se produce datorită sucțiune de la microorganisme sau bacterii care apare șoc infecțioase și toxice - una dintre complicațiile majore pneumonie, în care mortalitatea este de 30-50%.
Patogeneza pneumonie șoc.
La început, câteva concepte generale de șoc. Shock - o instabilitate hemodinamică acută caracterizată printr-o cădere critică a perfuziei tisulare, ceea ce duce la deficit de oxigen în țesuturi și organe povrezhdeniyukletok. Unul dintre cele mai importante șoc legăturile fiziopatologice este o violare a fluxului sanguin capilar, ceea ce duce la deficit de oxigen, tulburări metabolice, și în cele din urmă - la o stare ireversibilă.
Trebuie subliniat faptul că, în stare de șoc poate MM fi un indicator al perfuziei tisulare, așa cum sa demonstrat prin observarea emisiilor ridicate în șocul septic. Faptul că, în vasoconstricție severă și a fluxului sanguin suntul minut arterio-venoasă pot fi distribuite, astfel încât cele mai multe organe și țesuturi afectate de deficit de perfuzie la locul de muncă relativ normală sau chiar crescută a inimii ca o pompă. Prin urmare, atunci când un șoc este observat ca MOC scăzută și ridicată.
șoc toxic - se dezvoltă ca rezultat al expunerii la endotoxine și produse bacteriene asupra componentelor membranei celulare de coagulare a sângelui și complement, ceea ce duce la coagulability crescută, deteriorarea celulelor și întreruperea fluxului sanguin, în special microcirculației.
Sistemul complement este alcătuit din cel puțin 20 de diferite proteine de auto-aliniere și poate fi activat prin oricare din cel puțin doi factori de pornire. În timpul activării, sintetizată anterior proteinele active biologic sunt transformate în mediatori umorali ai inflamației și alterări ale țesuturilor. Activarea complementului are loc în etape, cum ar fi cascada de coagulare a sângelui. Educația complement determină liza membranei celulare de bacterii, celule roșii din sânge și alte țesuturi. Eliberată este în timpul activării complementului fragmentelor de peptide aplica alte sisteme efectoare celulare și umorale. Există două modalități de activare a sistemului complement: clasice și alternative. Activarea alternativă (numită properdina) poate avea loc sub influența factorilor neimunologice, indiferent de anticorpi. În literatura de specialitate, există dovezi de activare a complementului cu lipopolizaharide (endotoxina). Activarea complementului conduce la formarea de peptide moleculare scăzute - C3 factori complementari C4 și C5, mediază răspunsurile celulare și umorale. Fragmentele de C3a, C4a și C5a numit anafilatoxine. Ele stimulează eliberarea de histamină din mastocite și bazofile, provocând contracția musculaturii netede și permeabilitatea vasculară crescută. Se crede că fragmentul are activitate kinin C2, determinând o creștere a permeabilității vasculare. fragment C5a prin interacțiunea cu receptori specifici de înaltă afinitate granulocite și trombocite determină agregarea celulelor, adeziune crescute, chemotaxia și activarea celulelor. Neutrofilele activate astfel eliberate metaboliți ai acidului arahidonic, radicali liberi de oxigen și enzime lizozomale care cauzează modificări inflamatorii în țesuturi și crește permeabilitatea capilară. Acest mecanism poate avea o oarecare importanta in cauzand insuficienta respiratorie si vasodilatare in stare septică cauzate de microorganisme gram-negative.
Datele din literatură obținute în ultimii ani arată, de asemenea, că sub influența endotoxinelor și a altor produse bacteriene se disting prin citokine endogene, dintre care principalele obiective sunt celule sanguine albe, endoteliul si inima. mediatori inflamatori emergente să se citokine endogene au un impact major asupra tonusului vasomotor, permeabilitatea vaselor de sânge mici și agregarea leucocite și trombocite. Se schimbă porțiunea terminală a sistemului circulator. Acest lucru duce la pierderea tonusului a vaselor de rezistență (arteriale) și volumul (venos). Sângele se poate acumula în patul capilar și proteinele plasmatice în lichidul interstițial emanat. Sistemul venos este marcat, de asemenea, depunerea de sânge. Ca rezultat al stimulării b-receptor șunturilor arteriovenoase porțiunea deschisă de capăt a fluxului sanguin.
importanta in patogeneza Este suficient șocului toxic infecțioase și acum, de asemenea, dat la formarea de nitrat în organism. În cazul în care răspunsul inflamator în organism un rol-cheie în formarea de macrofage de nitrat de joc. enzime specifice Macrophage - NO-sintaza (macrofag, care este localizată în macrofage, mușchi neted și miocard) transformă arginina în NO, care este apoi se poate forma nitriți și nitrați. Funcția principală a NO, care este sintetizată de macrofage, este de a se asigura că efectele lor citotoxice. Când sunt activate de endotoxină bacteriană sau limfocite T macrofage spori sinteza NO-sintaza, care transformă arginina la NO. În picioare afară din macrofage, penetrează NO rapid în bacterii și celula moare. Astfel, nu joacă un rol important în apărarea imunitară a organismului. promovează în plus NO frontieră activitatea de reducere a celulelor inflamatorii, inhibă agregarea plachetară și îmbunătățește circulația sanguină locală. Patogenic același efect formarea de NO în organism poate fi după cum urmează în timpul inflamației. In procesele inflamatorii in organism pot forma specii de oxigen reactive, care sunt una dintre cele mai importante obiective moleculare pentru NO. NO se leagă la oxigenul, formând piroksinitrity, toxicitate după mai multe ori NU superioară. Ei apoi joacă un rol important în multe procese patofiziologice, inclusiv șocul septic, precum și leziuni ischemice și ulcerative ale organelor. Piroksinitrit provoacă daune proteinelor și lipidelor ale membranelor celulare, deteriorarea endoteliul vascular, trombocite agregare crește, este implicată în procesele de endotoxine. Sheer NO, excesiv acumulat in celula poate provoca deteriorarea ADN-ului și au o acțiune proinflamator în șocul septic.
Mecanismul de acțiune vasodilatatoare de NO
Astfel, în faza inițială a bolii sub influența endotoxinelor se produce în principal dilatarea pereților vaselor de sânge mici (în principal venule), și crește semnificativ permeabilitatea peretelui vascular. Ca urmare a celor de mai sus, în ciuda absenței unei sume absolute a deficitului, intoarcerea venoasa la inima este redus (hipovolemie relativă). Ca răspuns la acest lucru este îngustarea simpatic reflex al venelor. Dar constricție activă a venelor reduce in mod eficient de alimentare cu sânge venos numai dacă venele sunt bine umplute și întinse. Dacă presiunea transmurala este suficient de scăzut pentru a provoca venele în stare poluspavsheesya contracție mai puternică a musculaturii netede a venelor au doar un impact neglijabil asupra cantității de sânge în ele. Într-o astfel de situație restrângerea venelor poate chiar ușor creșterea capacității locale a venelor, deoarece face peretele mai rigide, rezultând în lumenul devine mai mare și devine mai de formă circulară, în ciuda faptului că circumferința lumenul este scăzut. Ca urmare, reducerea întoarcerii venoase este activitate crescută a sistemului nervos simpatic, care, în plus față de un efect direct al endotoxinelor conduce la o reducere a sfincterelor pre- și post-capilare (stimularea unei receptori). Ca rezultat, alimentarea cu sânge a țesuturilor devine debitului cardiac insuficient în această fază, cea mai mare parte a normale sau chiar ridicate (m. E. ISO normal sau mărit, crește ritmul cardiac, scade rezistența totală și a tensiunii arteriale periferice scade). diferența de oxigen arteriovenos asigura periferia oxigenului redus.
Ulterior, dezvoltarea în continuare a formării ca șoc fatal se produce un cerc vicios. sfinctere arteriale precapilare sunt mai sensibile la efectele toxice (inclusiv acidoză), astfel încât acestea sunt rapid înlocuite cu un spasm de pareză. Postcapilare (venular) sfinctere sunt mai rezistente la tulburări metabolice și lung rămân într-o stare de tensiune tonic. Astfel, sângele care intră în patul capilar este depozitat și, prin urmare, crește hipoxie tisulară, este agravată de acidoză metabolică, emanat de plasmă cu creșterea compresie a capilarelor, care, împreună cu stagnarea sângelui în circulația venoasă, contribuie la o reducere suplimentară a întoarcerii venoase și crește hipovolemie relativă.
Rezultatul este următoarea relație cauzală: stază în capilare - congestie visceral - îngrijirea apei - creșterea vâscozității sângelui - agregarea celulelor sanguine albe și roșii, formarea cheagurilor sanguine albe și roșii - epuizarea de coagulare și de trombocite factori datorită coagulare intravasculară diseminată - apariția debilitante coagulopatie cu sensibilitate crescută la sângerare.
În zonele afectate de cai de energie aerobe sunt trecut la glicolizei anaerobe. Comutarea metabolismului oxidativ la calea glicolitica crește semnificativ consumul de glucoza in timp ce reducerea randamentului ATP. Acest lucru conduce din nou la niveluri mai mici de glucoza. biosinteza proteinelor sub șoc este limitată. Acesta este un efect deosebit de rapid asupra sintezei proteinelor, care au un timp de înjumătățire scurt, cum ar fi factorii de coagulare. Astfel, probleme cu coagularea sângelui este îmbunătățită în continuare. În șoc începe randamentul de potasiu din celule. acidoză metabolică apare ca urmare a creșterii producției de lactat și piruvatului, o-cetoglutarat și corpilor cetonici. Acidoză compensată parțial de respirație de putere. Prin creșterea concentrației de H + în plasmă observat după: efect inotrop negativ asupra inimii; sfinctere precapilare scăderea sensibilității în reacțiile termeni vasomotorii, cu formarea de edem; crescând eliberarea de catecolamine; activarea sistemului de coagulare ca una dintre cauzele de coagulare intravasculară diseminată. Unele substanțe care rezultă din șoc (în special citokine însele) au un efect inotrop negativ. Efectele pe termen lung ale acestor factori conduce la extinderea insuficienței cardiace și a inimii, prin aceasta, pentru a reduce IOC.
Deosebit de sensibil la RES deficit de oxigen. Substanțe toxice, cum ar fi endotoxinele de încetare a intestinului să fie capturat RES (în special ficatul) și căderea fluxului sanguin în inimă și plămâni. Acest mecanism este considerat a fi un mare șoc schimbare care contribuie într-o fază ireversibilă parțial datorită dezvoltării vaselor periferice colaps ireversibil.
Rinichii. Din cauza vaselor eferente reducerea presiunii exercitate de șoc scade rata de filtrare glomerulară, rezultând în oliguria se dezvoltă (4-20 ml / h) sau anurie (4 ml / h). vasoconstricție renală persistă mult timp după normalizarea tensiunii arteriale. Ischemia determină necroză tubulară glomerular progresivă datorată, atunci eșecul de a forma un cilindru tubular în tubii distali. O indicație a insuficienței renale este o creștere a conținutului de sânge excretat în mod normal, în compușii urină, cum ar fi ureea și creatinina.
Relația dintre macro și microcirculației în stare de șoc.
Reducerea volumului de sânge, insuficiență cardiacă acută, vasculară periferică
Astfel, unul dintre principalele mecanisme fiziopatologice în dezvoltarea pneumoniilor șoc infecțioase și toxice să fie luate în considerare dezvoltarea hipovolemiei datorită sechestrării sângelui în microvasculature și ieșirile l la țesutul datorită creșterii permeabilității capilare.
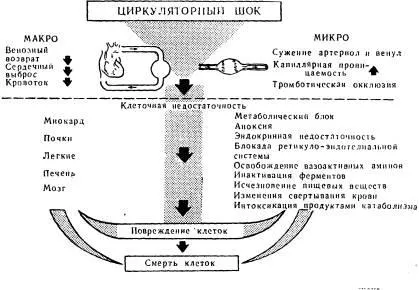
tulburări hemodinamice și relația acestora cu tulburări de ordin general în stare de șoc
Tabloul clinic. șoc se dezvoltă pe fondul creșterii intoxicației: pacientul are febră, urmată de o creștere bruscă a temperaturii, există adesea greață, vomă, diaree, stare de prostrație.
Din punct de vedere clinic sunt următoarele grupe de simptome, care determină severitatea și prognosticul.
Criteriile pentru sindromul sepsis