Rezolvarea problemelor de soluții de concentrare
Orice soluție constă dintr-un solvent și solutului. În cazul soluțiilor, gaze sau solide în lichide solvent considerate de obicei fluid și solut - gaz dizolvat sau un solid, indiferent de conținutul lor relative cantitativ. Când componentele au miscibilitate limitate, solventul este unul în care este posibilă adăugarea unei soluții în cantități nelimitate, fără a perturba omogenitate.
În cazul în care componentele au solubilitate nelimitată, cele două cazuri pot fi distinse. Atunci când o diferență semnificativă este considerată conținutul substanței solvent component prezent în cantități relativ mari. Conceptele de solvent și solut sunt lipsite de sens, atunci când este vorba de amestecuri de aproximativ concentrații egale sau apropiate ale componentelor.
Chimia folosit mai mult de o duzină de moduri de a-și exprima concentrare. Tabelul 1 de mai jos listează cele mai frecvent utilizate în practică, metodele de exprimare a substanțelor dizolvate în soluție.

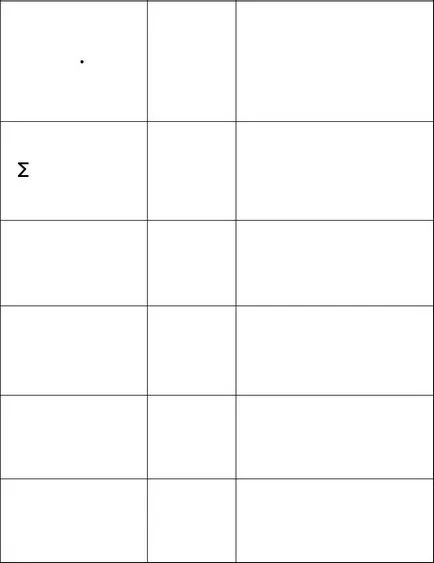
Tabelul 1 - Metode de compoziție soluție care exprimă
fracțiunea de masă a dizolvat
Substanța - raportul în greutate
Solutului la m
greutate soluție m p-pa
fracție molară a dizolvat
Problema - raportul koliches-
n Twa că substanța B la summar-
Numărul Nome de substanțe
Σn Bi. o parte a soluției,
solvent incluzând n S
Concentrația molară (MO
Polaritatea) - Raportul sumă
solute-operare
B [n B = m B / M B] la volum
Molar equivariant concentrare
Valens (Normal) - Raportul
numărul de echivalență
substanța B [n (1 / Z) = m B / M (1 / Z B)]
soluție la volumul V p-pa
concentrare molal (MO
lyalnost) - Raportul sumă
Solutului-operation
[N B = m B / M B] la greutatea dizolvată
Titer (concentrație de masă)
Soluția substanței - o concentrație
standard, dizolvat centrarea
ra egal cu masa substanței B
(M B) conținută în 1 cm3 (ml)
La 100 g de apă au fost dizolvate 82
Fracțiunea de masă de clorură de sodiu
unde ρ - densitatea soluției,
V r-ra - volumul soluției
ω = 82 g / 100 g (+ 82 g) = 0,45
n B i = n B 1 + n B + 2. valoare
Concentrația molară de KOH în soluție apoasă
unde M V - masa molară
soluție, egală cu 1 mol / dm 3 mijloace
în 1 dm 3 din această soluție conține
unde M (1 / B Z) - masa molară
echivalente în substanță
1 mol / dm 3 înseamnă că
soluție a conținut 1 echivalenți molari
cantitate vătămător de KOH
concentrația de molal KOH în soluție apoasă mol / kg, egală cu 1 mol / kg, mijloace
B1 kgvodyrastvoren1 molKOH
