Regula de fază

Apa cu gheață - sistem eterogen (a două faze eterogene un component)
În ceea ce privește terminologia oricărei soluții este la fel de corect să spunem ca un sistem omogen, și ca un sistem cu o singură fază omogenă. dar cuburile de gheata in apa - ca sistem neomogenă, și ca un sistem eterogen cu două faze. Selectarea termenul cel mai adecvat depinde de formularea problemei, deoarece diferența în ceea ce privește „sistem termodinamic“ și „faza termodinamică“ reflectă diferența în abordarea descrierii sistemului și faza. Sub fază capabil să înțeleagă un set utilizat pentru descrierea variabilelor intensive [3] [4]. O asemenea magnitudine intensă ca densitatea, căldura specifică, coeficientul de dilatare termică și altele. CaracterizaŃi proprietățile termodinamice ale substanțelor individuale sau faza care formează soluția. Însuși conceptul de fază termodinamic a fost introdus Gibbs să aibă „un termen care se aplică numai compoziția și starea termodinamică [...] a corpului și pentru care nu contează dimensiunea sau forma sa“ [5], în legătură cu regula faza de retragere bazată pe utilizarea Gibbs - Duhem. De aici rezultă aparținând natural A. V. Storonkinu detecție de fază ca o substanță individuală sau o soluție în toate condițiile posibile, permițând existența descrierii printr-o singură ecuație care exprimă relația dintre variabilele de stare [6] - ecuație Gibbs - Duhem sau oricare dintre ecuațiile canonice ale statului. Preferința ecuația Gibbs - Duhem, datorită faptului că toate variabilele independente în această ecuație reprezintă valoarea de intensitate.
Compoziția fiecărei faze este determinată de proporțiile componenților (molare sau în masă). Proporția fiecărei componente este absentă în faza examinată, este considerată ca fiind zero [7]. Folosind fracțiile molare necesită utilizarea tuturor fazelor aceeași unitate formula în calcularea numărului de moli de component [8]. In general, atunci când se analizează echilibrelor fază bazată pe faptul că transformarea chimică în sistem eterogen a luat deja în considerare la calcularea numărului de componente, astfel încât reacțiile chimice din sistem sunt luate în considerare [9].
Ocazional, în definiția „faza“ este o cerință pe termen introdus nu numai identitatea termodinamic, dar, în general, toate proprietățile macroscopice ale substanței. De exemplu, dextro- și levorotatori cristale optic active (cuart. Cloratul de potasiu si m. P.) Oferta considerate ca două faze diferite care diferă parametrii cristalografice. Cu toate acestea, proprietățile sale termodinamice ale unor astfel de substanțe sunt identice, iar acestea sunt considerate în mod tradițional, o singură etapă [10].
In cadrul termodinamicii Gibbs atunci când se analizează o substanță echilibre heterogen înainte și după tranziția de fază este considerată o singură etapă [10]. De exemplu, se consideră o singură fază α-Fe (ferită) cu proprietăți feromagnetice - stabil sub punctul Curie (769 ° C) Polimorf de fier. și β-Fe - Polimorful diferit de α-Fe magnetic (paramagnetic).
Pentru a defini starea termodinamică a sistemului, adică totalitatea proprietăților sale, cunoașterea insuficientă a proprietăților fazelor care constituie sistemul: .. Un set de variabile independente ale sistemului trebuie să fie prezentat cel puțin o cantitate extensivă, de exemplu, volumul sau masa sistemului [11].
grade termodinamice de libertate, și variația varianța totală a sistemului
În termodinamică, fiecare variabilă independentă de stat intensivă a cărei valoare poate fi modificată în mod arbitrar, cu condiția ca fazele de formare a sistemului, care nu dispare, și sunt formate noi faze, corespunde termodinamic un grad de libertate. Numărul de grade de libertate (variație) a sistemului este numărul de variabile intensive independente (pentru termo-sisteme exterioare este presiunea, temperatura și proporția componentelor în diferite faze), a căror valoare este necesar să se cunoască pentru a descrie pe deplin starea tuturor fazelor sistemului, și care pot în același timp, stabilită în mod arbitrar, fără a schimba numărul și natura fazelor (sistemul de fază, fără a schimba compoziția) [12] [13] [7]. Numărul de grade de libertate ale sistemului studiat este diferența dintre numărul de variabile intensive, care sunt suficiente pentru descrierea sa completă și numărul de legături între aceste variabile, t. E. egal cu numărul de variabile independente care permit variația arbitrară, care nu duce la o schimbare în natura sistemului [14].
Numărul de variabile independente necesare pentru definirea stării sistemului, ținând cont de masa tuturor fazelor sale, se numește complet varianței (total) a sistemului [11] [15].
Variance și variația totală poate lua numai valori întregi non-negative, iar valorile cele mai mici sunt zero [12].
Avem trei substanțe constituente și o reacție chimică, fără ecuații suplimentare de constrângere (deoarece în fiecare fază de o substanță), astfel încât sistemul de două componente. .. Un sistem închis, adică, o modificare arbitrară în componentele de acțiuni nu pot fi; Sistemul Thermodeformation, adică. e. pentru a lucra la sistemul poate schimba temperatura și presiunea. Experiența arată că pentru a descrie starea sistemului, doar o singură valoare. Dacă sistemul pentru a selecta o temperatură variabilă, presiunea de echilibru a dioxidului de carbon într-un sistem închis este unic determinat de temperatura setată și nu poate fi modificat în mod arbitrar, fără a pierde una dintre faze [16].
Ipotezele utilizate în derivarea regulii fazei
Aplicarea practică a fazei exclude o anumită problemă implică ipoteze de conformitate pre-calificate frecvent utilizate în derivarea acestei reguli [17]:
- sistemul este o fază de echilibru;
- ia în considerare doar volumetric (trei dimensiuni) faze, faza (de suprafață) cu două dimensiuni sunt excluse din calcul;
- limita dintre faze sunt plate, nu împiedică egalizarea presiunii și temperaturii în sistem și a substanțelor de transfer între faze;
- câmpuri de forță de impact (.. gravitaționale, magnetice, etc.) nu sunt luate în considerare și toate coordonatele generalizate termodinamice iau în considerare doar volumul și greutatea componentelor, adică luând în considerare numai deformarea termică a sistemului - .. deschis și închis.
Regula de fază se aplică numai pentru sistemele care sunt într-o stare de echilibru termodinamic. În natură, acest echilibru este de obicei absentă. De exemplu, în primăvara gheața se topește și dispare în anotimpul rece, apa îngheață și prezența comună a gheții și a apei - un fenomen temporar. În cazul în care acest sistem nu este pus în aplicare este posibil din motive de echilibru cinetică (prea mică rata de procese care duc la echilibru), apoi a făcut folosind concluziile regulii de fază poate să nu corespundă observațiilor actuale.
fază cerința respectării de echilibru nu permite excluderea (la echilibru faze metastabile general aplicabile [18]), întrucât eșecul oricărei alte dintre ipotezele de mai sus conduc la o modificare a formulelor regulii fazei [17].
Formularea regulii fazei pentru o varietate de izolare condiții de sistem
Formularea matematică a fazelor depinde de regulile impuse sistemului de izolare [19] [20]. Material izolator nu afectează numărul de etape într-un sistem eterogen, dar rupe legătura dintre numărul de fază și variația sistemului în cazul în care numărul de etape este mai mic sau egal cu numărul de componente [21]. Dacă în afară de relațiile exprimate de starea de material izolant, alte ecuații ale relației dintre intensitatea fazelor alternante, varianța și variația totală a sistemului va fi mai mic decât numărul acestor ecuații.
sistem deschis
Numărul de grade de libertate (număr de variabile intensive, care pot fi setate simultan valori arbitrare) ι sistem eterogen deschis multicomponent în echilibru prin găsirea raportului, care este formularea matematică a regulii fazei Gibbs [2]:
ι = 2 + k - f (ι = 0. 1. 2.).
(Regula de fază pentru sisteme deschise)
2 unde - numărul de grade de libertate, corespunzând unei presiuni și a temperaturii; k = 1. 2. 3. - numărul componentelor sistemului; f = 1. 2. 3. - numărul de faze din sistem.
Supuneți această regulă toate sistemele de echilibru deschise care constau din mai multe faze și orice număr de componente (prezența fiecărei componente în oricare dintre faze nu este de așteptat [22], [23]).
Direct de la regula de fază ar trebui să fie o limită a numărului de faze coexistente în sistem:
(Limitarea numărului de faze coexistente în sistem)
(Numărul maxim de faze într-un sistem eterogen)
Atunci când se utilizează ecuații pentru sistemele în care este stabilit un anumit număr de parametri, numărul de grade de libertate este redusă cu numărul de parametrii ficși [12]. Astfel, pentru sistemele condensate (de exemplu, aliaj metalic), atunci când presiunea în mod continuu sau efectul acesteia asupra stării de echilibru poate fi neglijat, varianța sistemului este una mai mică decât dată de ecuația Gibbs pentru variația sistemelor deschise [2].
Pentru sistemul cu un singur component
ι = 3 - f (ι ⩾ 0).
(\ Iota \ geqslant 0)>
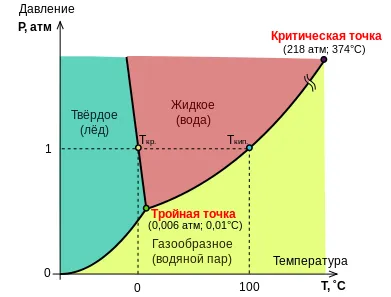
Diagrama de fază a apei
Rezultă că numărul maxim de etape de sistem cu un singur component este realizat cu minim (zero), varianța este egală cu trei; nici presiunea, nici temperatura sistemului cu un singur component cu trei faze nu poate fi stabilită în mod arbitrar. În diagrama de fază corespunde coexistența a trei faze punct triplu cu presiune fixă și temperatură. La orice altă temperatură, presiune sau alte trei faze de echilibru nu este posibilă: sistemul va fi schimbări care conduc la una sau două faze dispar.
În cazul enantiotropii și conversia unei faze polimorfa la cealaltă condiție de presiune constantă reduce variabilitatea sistemului 1, astfel încât schimbarea este posibilă numai la unul strict anumită temperatură (f = 2 k = 1. ι = 1 + k - f = 1 + 1 - 2 = 0
Două faze în echilibru în sistemul component (f = 2. ι = 1
\ Iota = 1>) corespunde liniei în diagrama de fază. Temperatura sistemului se poate da o valoare arbitrară, dar astfel presiunea de echilibru în cele două faze se vor preciza fără echivoc.
Dacă una din faze (f = 1. ι = 2
.. \ Iota = 2>), atunci numărul de grade de libertate a sistemului este de două, adică, temperatura și presiunea pot fi date valori arbitrare într-o anumită zonă în diagrama de fază - până când sistemul se află pe una dintre liniile de echilibru în două faze. Cel mai simplu exemplu al unui sistem monocomponent este o singură fază lichidă. presiune, care este mai mare decât presiunea vaporilor acestuia la o temperatură dată; în acest caz, aburul nu ar fi deasupra lichidului, r. e. un sistem monofazic va fi [25].
(Variație completă a unui sistem deschis)