reacții elementare Molecularity
Basic (simplu) numit de reacție care are loc într-o singură etapă. Ele sunt clasificate de obicei prin moleculară - numărul de particule care, în conformitate cu mecanismul de reacție stabilit experimental implicat în actul elementar de interacțiune chimică.
Monomolecular - reacții în care există o conversie chimică a unei molecule (izomerizare, disociere, etc ...):
Bimolecular - reacție act elementar care se realizează atunci când o coliziune a două particule (identice sau diferite):
Trimolecular - reacție act elementar care se realizează atunci când o coliziune a trei particule:
Reacții cu moleculară mai mult de trei necunoscute.
Pentru reacțiile elementare efectuate la concentrații similare de materii prime, și ordinea de magnitudini ale reacției moleculare coincid. Cu toate acestea, nici o relație între conceptele de ordine moleculare și reacția nu există bine definită, deoarece ordinea reacției caracterizată prin ecuația cinetică pentru reacția și molecular - mecanismul de reacție.
reacții complexe
numitele reacții chimice complexe care apar la mai mult de un pas. Să considerăm, de exemplu, de o cinetică de reacție complexe și mecanismul care sunt bine studiate:
Această reacție este o reacție de ordinul doi; Ecuația cinetică este după cum urmează:
Studiul mecanismului de reacție a arătat că este o în două etape (două etape se desfășoară în):
V1 Viteza primei etape este mult mai mare decât V2 viteza a doua etapă și viteza de reacție globală determinată de treapta de viteză mai lentă, limitare a vitezei sau așa-numitul.
In concluzie, este reacția unității sau complexe, se poate baza pe rezultatele unui studiu de cinetica sa. Reacția este complexă, în cazul în care ordinele de reacție parțiale determinate experimental nu coincid cu coeficienții materialelor de pornire într-o ecuație de reacție stoichiometrică; reacție complex privat poate fi fracționată sau negativă, poate include nu numai concentrația materiilor prime din ecuația cinetică este o reacție complexă, dar produșii de reacție.
Clasificarea reacțiilor complexe
Sequence se numește reacții complexe care apar în așa fel încât substanțele rezultate dintr-o singură etapă (adică, produșii acestei etape) sunt materiale pentru cealaltă etapă de pornire. Schematic, secvența de reacție poate fi reprezentată după cum urmează:
Numărul de pași și a materialelor implicate în fiecare etapă poate fi diferită.
Chemat reacții chimice paralele în care aceleași materii prime în același timp, se pot forma diverse produse de reacție, de exemplu, doi sau mai mulți izomeri:
complex conjugatul numit reacția are loc după cum urmează:
în care una dintre reacțiile poate proceda în mod independent, iar cealaltă este posibilă numai în cazul în care prima. O substanță care este comună pentru ambele reacții, este cunoscut ca un actor. Substanța -induktor. substanța D, care interacționează cu A în prezența numai prima reacție + acceptor. De exemplu, benzen într-o soluție apoasă de peroxid de hidrogen nu oxida, dar apare în conversia fenolului și difenil adăugarea de săruri de Fe (II). Mecanismul de reacție este după cum urmează. În prima etapă formarea de radicali liberi
care reacționează cu ionii și benzen Fe 2+:
Fe 2+ + OH • -> Fe 3+ + OH -
De asemenea, se produce recombinarea radicali:
astfel Ambele reacții continua cu comun intermediar radical liber OH •.
Efectul temperaturii asupra vitezei de reacție constantă
Constanta de viteză de reacție este o funcție de temperatură; Creșterea temperaturii crește de obicei, constanta de viteză. Prima încercare de a lua în considerare efectul temperaturii a fost făcută de van't Hoff, care a formulat următoarea regulă de degetul mare:
Când temperatura crește la o viteză constantă de 10 de grade la fiecare rată de reacție chimică elementară este crescută cu 2 - 4 ori.
Valoare care arată cât de multe ori rata crește constant ca temperatura creste cu 10 grade, există un coeficient de temperatură de y constantă a vitezei de reacție. Matematic regula van't Hoff poate fi scris după cum urmează:
Cu toate acestea van't regula Hoff este aplicabilă numai într-un interval de temperatură îngust, deoarece coeficientul de temperatură al y viteza de reacție este ea însăși o funcție de temperatură; la γ foarte mari și foarte scăzute temperaturi devine egal cu unitatea (adică, viteza de reacție chimică devine independentă de temperatură).
Evident, interacțiunea dintre particule se realizează atunci când acestea se ciocnesc; cu toate acestea, numărul de coliziuni ale moleculelor este foarte mare și în cazul în care fiecare coliziune conduce la particule de interacțiune chimice, toate reacțiile au procedat practic instantaneu. Arrhenius postulat că moleculele de coliziune vor fi eficiente (adică va provoca reacția) numai dacă moleculele de coliziune au o energie de rezervă - energia de activare.
Energia de activare este de minim energia pe care trebuie sa aiba molecule care ciocnirea lor ar putea conduce la o reacție chimică.
Luați în considerare calea unor reacții elementare
Deoarece reacția chimică a particulelor, datorită discontinuității legăturile chimice vechi și formarea de noi, se crede că fiecare reacție are loc elementare prin formarea intermediarului instabil numit complex activat:
Formarea complexului activat presupune întotdeauna cheltuielile o anumită cantitate de energie, care este cauzată, în primul rând, repulsia cojilor electronice și nucleii particule de apropiere și, în al doilea rând, necesitatea de a construi o anumită configurație spațială a atomilor în redistribuirea complexă și activată a densității de electroni. Astfel, pe drumul de la starea inițială a sistemului final trebuie să depășească un fel de barieră de energie. Energia de activare este aproximativ egală cu excesul de energie medie a complexului activat peste energia medie a reactanților. Evident, dacă reacția înainte este exotermă, EA energia de activare a reacției inverse este mai mare decât EA reacția directă a energiei de activare. Energiile de activare a transmite și reacțiile inverse sunt conectate între ele prin schimbarea energiei interne în timpul reacției. Cele de mai sus poate fi ilustrată prin schema energetică a reacției chimice (fig. 2.5).

Fig. 2.5. Diagrama energetică a reacției chimice. Eiskh - energia medie a particulelor materiilor prime, Eprod - energia medie a particulelor produșilor de reacție.
Deoarece temperatura este o măsură a energiei cinetică medie a particulelor, creșterea temperaturii duce la o creștere a proporției de particule a căror energie este egală sau mai mare decât energia de activare, ceea ce conduce la o creștere constanta vitezei de reacție (Figura 2.6):
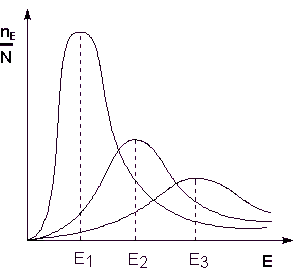
Fig. 2.6. Distribuția de energie a particulelor. Aici, Ne / N - fracția de particule având o energie E; Ei - energia medie a particulelor la o temperatură Ti (T1 Să considerăm o expresie de ieșire termodinamic care descrie dependența constanta vitezei de reacție a temperaturii și energia de activare - ecuația Arrhenius. Conform isobars ecuație van't Hoff, Deoarece constanta de echilibru este raportul dintre constantele ratei de forward și reacții inverse pot fi rescrisă ca expresie (II.31), după cum urmează: Reprezentarea schimbarea entalpie a ΔHº de reacție ca diferența dintre cele două valori E1 și E2. obținem: Aici, C - o constantă. Postulează că C = 0, obținem ecuația Arrhenius unde EA - energia de activare: După integrarea nedefinită de exprimare (II.35) se obține ecuația Arrhenius în formă integrală: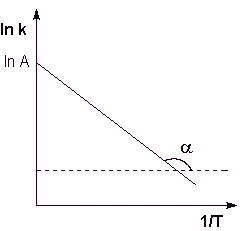
Fig. 2.7. Logaritmul viteză constantă reacție chimică împotriva temperaturii reciproce.
Aici, A - constanta de integrare. Din ecuația (II.37) nu este greu de a arăta semnificația fizică a factorului A pre-exponențială, care este egală cu o rată constantă de reacție la o temperatură care tinde la infinit. După cum se vede din expresia (II.36), logaritmul constantei depinde liniar de inversul ratei de temperatură (figura 2.7); Valoarea EA a energiei de activare și de pre-exponențială log factorul A poate fi determinată grafic (panta unei linii drepte la abscisă și intercepta pe linia ordonată).
Cunoscând energia de activare a reacției și constanta vitezei la orice temperatură T1. pe ecuația lui Arrhenius poate calcula constantele de viteză la orice temperatură T2: